Neue genomische Techniken bei Pflanzen: Was die Gen-Schere kann - und was (noch) nicht
Von Juliette Irmer
Mit dem CRISPR/Cas-Verfahren lässt sich das Erbgut so einfach und präzise umschreiben wie noch nie. Das Potenzial der „Gen-Schere“ ist vor allem in der Pflanzenzüchtung gewaltig. Es könnten sich Pflanzen züchten lassen, die Schädlingen trotzen, Pestizide einsparen und dabei mehr Ertrag liefern. Womöglich auch Pflanzen, die Trockenheit und salzhaltige Böden tolerieren. Doch sind die Erwartungen gerechtfertigt? Was können Genome Editing-Verfahren tatsächlich leisten – schon jetzt und in naher Zukunft?
Um den Hype, insbesondere um die Gen-Schere CRISPR/Cas zu verstehen, hilft ein kurzer Blick in die Geschichte der Pflanzenzucht.
Die Ahnen von Mais und Weizen waren Wildgräser mit ziemlich kümmerlichen Fruchtständen. Jahrtausende lang wählte der Mensch die ertragreicheren unter ihnen zur Zucht aus und fuhr mit der Zeit bessere Ernten ein. Das war möglich, weil sich Pflanzen einer Art genetisch unterscheiden, sie weisen unterschiedliche DNA-Veränderungen auf, so genannte Mutationen. Manchmal führen solche Mutationen zu gewünschten Merkmalen wie größere Fruchtstände. Indem der Mensch immer nur jene Pflanzen mit hohem Ertrag auswählte, wählte er also für ihn vorteilhafte Mutationen aus.
Einen gewaltigen Schub erhielt die Pflanzenzucht Mitte des 20. Jahrhunderts als entdeckt wurde, dass man Mutationen auch künstlich hervorrufen kann: Setzt man Pflanzensamen ionisierenden Strahlen oder Chemikalien aus, löst das massenweise Mutationen aus, die zu potenziell interessanten, neuen Eigenschaften führen können. Durch diese ungerichtete Mutagenese erhält man immer eine Mischung aus Mutationen: Die meisten sind neutral, wenige sind negativ und sehr wenige positiv. Das heißt, so behandelte Pflanzen weisen zunächst meist erwünschte wie unerwünschte Merkmale auf. Um eine neue Sorte zu erhalten, die altbewährte und neuen Eigenschaften in sich vereint, sind oft mehrere, sich über Jahre hinziehende Rückkreuzungsschritte erforderlich. Auf diese Weise sind die über 3000 weltweit erhältlichen Kulturpflanzen entstanden, etwa Hartweizen, aus dem Nudeln gefertigt werden.
Die nächste Stufe der Pflanzenzucht war die klassische Gentechnik: Genetiker isolierten Gene, die für bestimmte Eigenschaften standen, etwa die Resistenz gegen Schädlinge, und überführten sie in das Erbgut von Pflanzen. Eine Methode, die bis heute auf Kritik stößt. Gentechnikgegner stören sich vor allem an zwei Punkten: Die Übertragung von „fremden“ Genen über alle Art- oder Gattungsgrenzen hinweg, etwa das Einfügen eines Bodenbakterium-Gens in Mais (Bt-Mais), das der Abwehr bestimmter Insekten dient. Und die Tatsache, dass das Einfügen eines Gens dem Zufall überlassen wird, also niemand vorhersagen kann, wo das zusätzliche Gen im Erbgut integriert wird, was zu unerwünschten Merkmalen führen kann. Da allerdings jede neue Pflanzensorte, unabhängig von ihrer Zuchtmethode, vor ihrer Zulassung eingehend geprüft wird, gelangen Pflanzen mit unerwünschten Eigenschaften gar nicht erst auf den Acker.
Präzision statt Zufall
Bei Pflanzen, die mithilfe von Genom-Editing-Verfahren gezüchtet werden, fallen die Kritikpunkte zum großen Teil weg: Sind die Gene bekannt, die mit bestimmten Eigenschaften einer Pflanze assoziiert sind, müssen Pflanzenzüchter sich nicht länger auf den Zufall verlassen, sondern können das Erbgut gezielt am Wunschort verändern.
Im aktuellen Vorschlag der EU-Kommission für eine Reform der Gentechnik-Gesetze wird Genome Editing – etwa CRISPR/Cas oder TALEN – den Neuen genomischen Techniken (NGT) zugerechnet.
Grundsätzlich unterscheidet man drei Kategorien an Veränderungen, was bei einer zukünftigen Regulierung solcher Pflanzen eine Rolle spielt:
- Punktmutationen, also Austausch einzelner DNA-Bausteine (Nukleotide)
- Einfügen oder Löschen weniger Nukleotide (Die EU-Kommission hat eine Obergrenze von 20 Nukleotiden vorgeschlagen.)
- Einfügen arteigener oder artfremder Gene
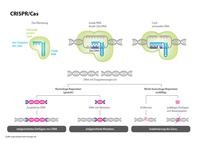
Suchen, Schneiden, reparieren. Wie die Gen-Schere funktioniert: Mehr dazu im Lexikon: Crispr/Cas
Die Ziele der „neuen Gentechnik“ unterscheiden sich dabei nicht von den Zielen der alten Gentechnik oder der traditionellen Zucht: Immer geht es darum Nutzpflanzen an die Bedürfnisse des Menschen anzupassen, sie also ertragreich und resistent gegen Krankheitserreger und Schädlinge zu machen.
Das gilt heute in Zeiten des Klimawandels mehr denn je: Extreme Wetterereignisse wie Starkregen und anhaltende Trockenperioden nehmen in vielen Regionen zu, was zu Ernteausfällen und vermehrtem Schädlingsbefall führen kann. Gleichzeitig verabschieden viele Regierungen schärfere Pflanzenschutzregeln, die eine Verringerung des Pestizideintrags in der Landwirtschaft vorsehen. Um die Ernährungssicherheit weltweit zu gewährleisten, auch vor dem Hintergrund einer weiter zunehmenden Weltbevölkerung, braucht es also ertragreiche und noch robustere Pflanzensorten.
CRISPR/Cas ist aufgrund seiner praktischen Eigenschaften - die Methode ist präzise, günstig, einfach zu handhaben - inzwischen das klar dominierende Genome Editing-Verfahren. Verschiedene Übersichtsarbeiten und Datenbanken versuchen die weltweit laufenden NGT-Studien zu erfassen. Laut der EU-SAGE (European Sustainable Agriculture Through Genome Editing) Datenbank, einem Netzwerk aus 134 europäischen Forschungsinstituten, wird weltweit an insgesamt 72 Pflanzenarten geforscht. Klar die Nase vorn hat bei den untersuchten Nutzpflanzen Reis, gefolgt von Tomaten, Weizen, Kartoffeln, Mais und Sojabohnen. Geforscht wird aber auch an Erdbeeren, Kopfsalat und Kiwis.
Noch handelt es sich überwiegend um Grundlagenforschung, etwa eine von 20 Studien ist marktorientiert. Neben den Klassikern wie Ertrag und Widerstandsfähigkeit gegenüber Krankheiten arbeiten Forscher auch an der Lagerfähigkeit und Produktqualität: Sie entwickeln allergenfreie Erdnüsse, Kartoffeln, die beim Erhitzen weniger Acrylamid produzieren, Weizen mit reduziertem Glutengehalt, Reis mit unterschiedlich hohem Amylose-Anteil, oder Bananen mit einem höheren Vitamin A-Gehalt.
Zugelassen und angebaut wird in den USA bislang eine Sojabohne deren Fettsäureprofil mithilfe einer älteren Genome-Editing-Technik verbessert wurde. 2021 wurde außerdem eine CRISPR-Tomate in Japan zugelassen, deren Verzehr dank einer höheren GABA-Konzentration den Blutdruck senken soll und 2023 führte das US-Startup Pairwise eine CRISPR-Salatmischung aus lila und grünem Senfgrün ein, welches weniger bitter schmeckt. Mit weiteren Zulassungen ist in Kürze zu rechnen, da viele Länder ihre Regulierungen an den wissenschaftlichen Fortschritt angepasst haben.
Was möglich ist
Veränderte Genaktivität. Ein Großteil aller durchgeführten Studien nutzt CRISPR, um Punktmutationen und kleinere Insertionen in bestimmte Gene einzufügen. Auf diese Weise lassen sich Gene schnell und unkompliziert ausschalten, um dann zu beobachten, wie sich das auf die jeweilige Pflanze auswirkt. CRISPR ist damit zu einem unersetzlichen Werkzeug der Grundlagenforschung avanciert. Etliche Beispiele zeigen das Potenzial der Methode für die Pflanzenzucht: Schaltet man in Baumwolle etwa ein bestimmtes Gen aus, verbessert sich das Seitenwurzelwachstum, was die Pflanze besser gedeihen lässt.
Beschleunigte Domestizierung. CRISPR und Co eröffnen Pflanzenzüchtern neue Wege der Pflanzenzucht: Durch Erbgutvergleiche von Wild- und Kulturpflanzen lassen sich jene Gengruppen identifizieren, die im Zuchtverlauf verändert wurden. Die heutigen Kulturpflanzen gelten als genetisch verarmt, weil das Zuchtziel meist auf einen hohen Ertrag ausgerichtet war. Mithilfe von CRISPR/Cas ließe sich der Domestikationsprozess neu starten und im Idealfall erhielte man Nutzpflanzen, mit den Vorteilen der Wildpflanzen, die in der Regel robuster sind und oft auch besser schmecken, und jenen von Kulturpflanzen, die ertragreicher sind. Forschern der Universität Münster ist das im Rahmen eines Verbundprojekts am Beispiel der Wildtomate Solanum pimpinellifolium gelungen: Mithilfe von Multiplex-CRISPR-Cas9 schalteten die Forscher gleich sechs Gene der Wildtomate aus. Diese produziert sehr aromatische Früchte, die aber nur erbsengroß sind. Nach nur einer Pflanzengeneration erzielten die Forscher die gewünschten Effekte: Ein verbesserter Wuchs, mehr Blüten, größere Früchte und einen höheren Gehalt an Lycopin, einem Antioxidans.

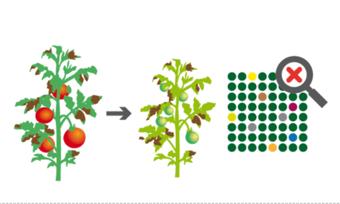
Das geht. Mit CRISPR/Cas können Pflanzen widerstandsfähiger gegen Pilzkrankheiten werden. Das trägt dazu bei, weniger Pflanzenschutzmittel einzusetzen. (Foto: Mehltaubefall bei Weizen)
Nachhaltiger und gezielter Pflanzenschutz. Viele Pflanzenschutzmittel büßen mit der Zeit ihre Wirksamkeit ein, weil Schädlinge oder Krankheitserreger resistent werden. Andere werden aufgrund ihrer unspezifischen Wirkung, die sich auch für Nützlinge als schädlich erweist, verboten.
Genome Editing eignet sich gut, um Pflanzen resistent zu machen gegen Krankheitserreger wie Viren, Bakterien und Pilze, weil dafür oft die Veränderung einzelner Gene ausreicht. In China etwa haben Wissenschaftler eine Punktmutation in einem Gen der Weinrebe erzeugt, das in der Schädlingsabwehr eine Rolle spielt, wodurch die Reben Grauschimmel besser tolerieren. Bei Weizen wurde mithilfe von CRISPR/Cas das MLO-Gen inaktiviert, wodurch Weizen resistent wird gegen Mehltau. Andere Ansätze zielen darauf, die pflanzeneigene Abwehr zu verstärken. So konnten mithilfe von CRISPR/Cas die in wenigen Reissorten natürliche Resistenz gegen Xoo-Bakterien ausgeweitet werden. Xoo-Bakterien rufen die gefürchtete Weißblättrigkeit hervor indem sie den Zuckervorrat der Reispflanzen anzapfen.
Anders als beim chemischen Pflanzenschutz sind die Genome Editing-basierten Konzepte hochspezifisch: Sie zielen ausschließlich auf einen ganz bestimmten Krankheitserreger, weswegen weniger Beeinträchtigungen anderer Tiere und Pflanzen zu erwarten sind. Durch solche Ansätze könnte der Einsatz von Pflanzenschutzmitteln reduziert werden.
Schneller als die Krankheitserreger. Erreger von Pflanzenkrankheiten, meist Pilze, aber auch Viren oder Bakterien, befinden sich in einem evolutiven Wettrüsten mit der Pflanze: Es ist meist nur eine Frage der Zeit, bis sie die in Kulturpflanzen vorhandenen oder eingezüchteten Resistenzen überwinden oder auch Pflanzenschutzmittel ihre Wirksamkeit verlieren. Denn das Erbgut von Erregern ist veränderlich, ebenso das von Pflanzen: Mutationen geschehen permanent, sie sind der Motor der Evolution. Wird ein Erreger aufgrund einer neuen DNA-Veränderung nun unempfindlich gegen ein Pflanzenschutzmittel, vermehrt sich fortan nur noch dieser Erreger. Pflanzenzüchter müssen mit diesen Entwicklungen Schritt halten. Je nach Kulturart kann es mit den heute üblichen Methoden allerdings 15 bis 30 Jahre dauern, bis eine neue widerstandsfähige Sorte entwickelt und zugelassen ist. Mithilfe der Genome Editing-Methoden können Züchter im Wettlauf mit den Erregern Zeit gewinnen.

Das geht noch nicht. Aus der Forschung sind Konzepte bekannt, wie bestimmte Pflanzen sich gegen Trockenheit wappnen. Mit diesem Wissen könnten dank CRISPR/Cas schon bald Pflanzen entwickelt werden, die besser an die Folgen des Klimawandels angepasst sind.
Was (noch) nicht möglich ist
So vielversprechend Genome Editing ist – die Methoden haben ihre Grenzen. Pflanzen lassen sich mit CRISPR und Co zwar präziser und schneller verändern. Aber nach dem Erreichen des Editierziels schließen sich – wie bei konventionell gezüchteten Pflanzen auch – meist mehrere Jahre Züchtungsarbeit an, in denen die neue Pflanzensorte auf ihre veränderten Eigenschaften hin überprüft wird und in der sie sich in Freilandversuchen beweisen muss.
Komplexe Pflanzeneigenschaften wie Salz- oder Trockenresistenz lassen sich auch mit Genome Editing nicht ohne weiteres in Nutzpflanzen zaubern. Denn an solchen Eigenschaften sind meist mehrere Gene beteiligt. Manchmal handelt es sich bei diesen Genen um Transkriptionsfaktoren, die gleich in mehreren Stoffwechselwegen einer Pflanze eine Rolle spielen. Schaltet man ein solches Gen aus oder an, zeigt sich manchmal, dass eine bessere Resistenz gegen Trockenheit mit Nachteilen in anderen Bereichen einhergeht. Studienergebnisse weisen jedoch daraufhin, dass sich bestimmte Stoffwechselwege mit NGT-Techniken so beeinflussen lassen könnten, dass Reis, Tomaten und Weizen Trockenheit besser tolerieren.
Problematisch ist auch das Erzeugen von Resistenzen gegen tierische Schädlinge, etwa Fraßinsekten. Die in den Pflanzen genetisch angelegten Abwehrmechanismen umfassen oft Stoffe, die die Produktqualität beeinflussen können oder gar giftig sind wie etwa die Glykoalkaloide der Kartoffel. Aus diesem Grund ist man in diesem Bereich weiter auf klassische Gentechnik angewiesen.
Ineffizient ist momentan auch noch das Einführen von größeren DNA-Veränderungen mit CRISPR. Denn CRISPR schneidet DNA an einer vorgegebenen Stelle (siehe Grafik oben). Die Reparatur der Schnittstelle wird aber der zelleigenen Maschinerie überlassen und in Pflanzen funktioniert der Reparaturprozess, der zum Einfügen größerer DNA-Abschnitte benötigt wird, nicht zuverlässig.
Genome Editing und NGT-Verfahren sind demnach kein Wunderwerkzeug mit dem sich auf einen Schlag alle Probleme der Pflanzenzucht beseitigen lassen, dennoch haben die Methoden das Potenzial, die Pflanzenzucht ein Stück weit zu revolutionieren: Die Zucht neuer Pflanzensorten geht schneller und es werden wesentlich weniger DNA-Veränderungen eingebracht als mit herkömmlichen Zuchtmethoden.
Grafik Bing Image Creator, Fotos: Archiv i-bio, Jay Jenner
Diskussion / Kommentare
 Kommentare werden geladen…
Kommentare werden geladen…
Themen
Im Web
- EU-Kommission/JRC, New Genomic Techniques, Data mash-up
- Stellungnahme der ZKBS zum Vorschlag der Europäischen Kommission zur Neuregulierung von Pflanzen, die mit „Neuen Genomischen Techniken (NGT)“ gezüchtet wurden, Oktober 2023
- The First Crispr-Edited Salad Is Here; Wired 16 May 2023
- Thorben Sprink, Ralf Wilhelm, Frank Hartung, Genome editing around the globe: An update on policies and perceptions; Plant Physiology, Volume 190, Issue 3, November 2022
- Syed Shan-e-Ali Zaidi et al; Engineering crops of the future: CRISPR approaches to develop climate-resilient and disease-resistant plants; Genome Biology Volume 21, 30 Nov 2020
- Van Schepler-Luu et al; Genome editing of an African elite rice variety confers resistance against endemic and emerging Xanthomonas oryzae pv. oryzae strains; bioRxiv, 22 Nov 2022
- Jochen Menz et al, Genome Edited Crops Touch the Market: A View on the Global Development and Regulatory Environment; Frontiers in Plant Science, 09 Oct 2020
- Kevin V. Pixley et al, Genome-edited crops for improved food security of smallholder farmers; Nature Genetics vol 54, 7 Apr 2022
- Quier Lu et al, Application of CRISPR/Cas9 in Crop Quality Improvement; Int J Mol Sci, 22 Apr 2021