Das Fleisch der Texel-Schafe: Genome Editing in der Tierzucht
Das Hausschaf ist durch menschliche Domestikation aus dem Mufflon hervorgegangen, wobei insbesondere Tiere gezüchtet wurden, die eine hohe Milchleistung, einen guten Fleischansatz und eine qualitativ hochwertige Wollproduktion aufwiesen. In den schätzungsweise 10.000 Jahren, in denen Schafe als Haustiere gehalten wurden, hat der Mensch durch gezielte Auswahl Schafe gezüchtet, die sich in ihrer Ausstattung an Genen wesentlich unterscheiden. Dabei spielen insbesondere Varianten der Gene eine entscheidende Rolle bei der Ausprägung der Eigenschaften einer Schafrasse.
Ein beliebtes Fleischschaf ist das Texelschaf, das ursprünglich auf der niederländischen Nordseeinsel Texel gehalten wurde und wegen seiner hervorragenden Fleischeigenschaften jetzt im großen Stil auch in Neuseeland und Australien weitergezüchtet wird. Vor zehn Jahren hat eine Forschergruppe festgestellt, dass Texelschafe eine Mutation im Gen, das für Myostatin codiert, aufweisen und dass diese Mutation zu den beliebten Fleischeigenschaften mit hervorragenden Lammkeulen führt. Myostatin ist ein Hemmer des Muskelwachstums und durch die Mutation wird im Texelschaf weniger Myostatin produziert, so dass entsprechend mehr Muskelgewebe ausgebildet wird. Die Mutation im Myostatin-Gen ist ein einziger Basenaustausch von G zu A in der Regulationssequenz unterhalb der DNA-Sequenz, die für das Protein Myostatin codiert. Diese Veränderung von nur einem Basenpaar führt dazu, dass weniger Myostatin gebildet wird. Diese erniedrigte Aktivität des Myostatin-Gens erklärt wahrscheinlich, dass die Texelschafe wohl proportioniert sind. Im Gegensatz dazu führt ein Totalausfall des Myostatin-Gens bei Rindern zu ungelenken Tieren, da sie viel zu viel Muskelmasse herumschleppen.
Da die Texelschafe nicht reinrassig sind, besteht die Gefahr, dass die Mutation im Myostatin-Gen verloren geht. Um dies zu vermeiden, lässt Heinz Plüss, ein passionierter Halter von Texelschafen, seine Tiere auf das mutierte Myostatin-Gen testen. Dabei stellt er, wie zu erwarten, bei der Anwesenheit des mutierten Gens eine erhöhte Bemuskelung fest.
Schafzüchter möchten natürlich sehr gern die hervorragenden Fleischeigenschaften des Texelschafs auf andere Schafsrassen übertragen, so dass zum Beispiel das schwarze ost-friesische Milchschaf mit guter Milchleistung auch viel Muskelgewebe ansetzt. Dies ist aber nicht einfach, da ja bei jeder Kreuzung nicht nur das mutierte Myostatin-Gen allein weitervererbt wird, sondern auch viele andere Gene, die unter Umständen gar nicht erwünscht sind. Zusätzlich hat der Züchter das Problem bei den Nachkommen diejenigen Tiere zu erkennen, die die gute Milchleistung zeigen. Im Idealfall wird der Züchter nach vielen Jahrzehnten eine Schafsrasse etablieren können, die hohe Milchleistung und gute Fleischeigenschaften hat. Diese neue Schafsrasse wird sich von der verwendeten Milchrasse in vielen Eigenschaften unterscheiden, da es unmöglich ist alle Gene der Milchrasse beizubehalten und nur das mutierte Myostatin-Gen einzubringen.
Genome Editing des Myostatin-Gens
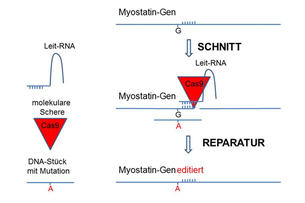
Einen eleganten Ausweg ergibt sich durch das Genome Editing, mit dem ganz gezielt der Basenaustausch G zu A an der richtigen Stelle des Myostatin-Gens vorgenommen werden kann. Das Vorgehen wäre wie folgt:
Eine Eizelle wird aus einem Milchschaf entnommen und in vitro mit den Spermien des Milchschafs befruchtet. Diese befruchtete Eizelle wird dann mit einer Lösung injiziert, welche die für das Genome Editing benötigten drei Komponenten enthält (Genome Editing):
- Eine Leit-RNA, die ganz spezifisch die Region im Myostatin-Gen erkennt.
- Eine RNA, die für die molekulare Schere Cas9 codiert, die die DNA an der Stelle schneidet, an der die Leit-RNA gebunden ist.
- Ein kurzes DNA-Stück, das die zu mutierende Region des Myostatin-Gens enthält und die erwünschte Mutation von G zu A trägt.
Beim Genome Editing wird sich die Leit-RNA durch Basenpaarung am Myostatin-Gen anlegen und damit die molekulare Schere Cas9 an diesen Ort lenken und genau dort die DNA durchtrennen. Die Zelle erkennt diese Schnittstelle und wird sie reparieren, wobei das kurze DNA-Stück mit der Mutation als Anleitung verwendet wird. Somit stellt die Reparatur die DNA wieder so her, dass die Mutation G zu A nun in der reparierten DNA vorhanden ist.
Die Eizelle entwickelt sich in vitro weiter und wird nach sechs Tagen als Blastocyste in den Uterus eines Schafs (Amme) eingeführt, wo sich der Embryo weiterentwickelt. Nach fünf Monaten wird das Ammenschaf ein Lamm gebären, das im Idealfall ein mutiertes Myostatin-Gen trägt. Aus den bisherigen Erfahrungen weiß man, dass etwa 40 Prozent der eingepflanzten Blastocysten sich normal weiterentwickeln und 10 bis 40 Prozent der Lämmer die gewünschte Mutation tragen. Hierbei stellt man fest, dass in der Regel beide Allele, d.h. das väterliche und mütterliche Gen, mutiert sind. Man erhält somit mit einer guten Ausbeute homozygot mutierte Schafe, die für die Etablierung einer Milchrasse mit guter Fleischproduktion eingesetzt werden können. Neben der Mutation im Myostatin-Gen sind keine Veränderungen zu erwarten, da die Leit-RNA und die RNA, die für die molekulare Schere codiert, abgebaut und nicht ins Genom eingebaut werden. Man weiß, dass die molekulare Schere in seltenen Fällen unkontrolliert die DNA an anderen Stellen schneiden kann. Diese Schnittstellen werden durch die Zelle repariert, wobei an diesen Stellen Mutationen auftreten können. Diese Mutationen sind aber kaum von Bedeutung, da schon normalerweise in einem Nachkommen etwa 50 Mutationen spontan auftreten.
Die Frage stellt sich, ob diese Genome-editierten Schafe ohne Bedenken gezüchtet werden dürfen, sie gesund sind und deren Fleisch für die menschliche Ernährung unbedenklich ist.
Ethische Bedenken: Menschen haben seit Tausenden von Jahren durch Selektion Schafe gezüchtet und hierbei aus der Vielfalt der natürlich entstanden Mutationen diejenigen ausgewählt, die für den Menschen von Nutzen sind. Mit dem Genome Editing wird nun eine natürlich vorkommende Mutation gezielt in eine Schafsrasse eingeführt, wobei ausschließlich der G zu A Basenaustausch im Myostatin-Gen erfolgt. Im Gegensatz zu der klassischen Genmanipulation werden also keine artfremden Gene eingebracht. Die neu etablierte Schafsrasse beinhaltet Genkombinationen wie sie in den etablierten Rassen vorkommen. Der Genpool des Schafs wird nicht verändert und somit ist eine unnatürliche Veränderung der noch wild lebenden Mufflons nicht möglich. Zurzeit ist unklar, ob Tiere, die durch Genome Editing entstanden sind, rechtlich gesehen als gentechnisch veränderte Organismen (GVO) einzustufen und somit den entsprechenden gesetzlichen Bestimmungen unterworfen sind. Aus wissenschaftlicher Sicht ist das gezielt im Myostatin-Gen veränderte Schaf mit einem aus natürlicher Zucht entstandenen Schaf gleichzusetzen.
Gesundheit des genom-editierten Schafs: Da das Schaf eine Genvariante des Myostatin-Gens trägt, die beim Texelschaf natürlicherweise vorkommt und dort zu keiner Beeinträchtigung des Wohlbefindens führt, ist mit keinen Gesundheitsproblemen zu rechnen. Das Verfahren des Genome Editing ist mit dem Verfahren der künstlichen in vitro Befruchtung vergleichbar und somit selten mit ungewollten Veränderungen oder sogar Fehlbildungen verbunden. Damit unterscheidet es sich auch vom Klonen, wo oft kranke Tiere entstehen (zum Beispiel das erstmals vor 20 Jahren klonierte Schaf Dolly). Das Verfahren der Klonierung ist deshalb wesentlich risikoreicher, da in der entkernten Eizelle der eingebrachte Körperzellkern umprogrammiert werden muss und dieser Prozess mit Fehlern behaftet ist. Allerdings müssen bei der Zucht einer neuen Schafsrasse mit Genome Editing die guten Regeln der Züchtung berücksichtigt werden, um Probleme einer Inzucht zu vermeiden. Es ist daher sicher wichtig, die neue Rasse aus mehreren Schafen abzuleiten, deren Myostatin-Gen genom-editiert ist, um eine möglichst große genetische Vielfalt zu erhalten.
Der Verzehr von Fleisch aus genom-editierten Schafen: Da Texelschafe sich seit Jahren als gute Fleischlieferanten bewährt haben, ist der Verzehr des Fleisches von den Genom-editierten Schafen völlig unbedenklich, da sie ja keine anderen Gensequenzen enthalten. Niemand würde den Verzehr von Schaffleisch in Frage stellen, dessen Ursprung auf der Kreuzung unterschiedlicher Rassen beruht.
Offensichtlich hat das Genome Editing ein großes Potenzial und man kann nur hoffen, dass die rechtliche Situation, ob es sich nun um einen genveränderten Organismus handelt oder nicht, bald geklärt ist. Aus meiner Sicht sind Tiere, die durch Genome Editing gezüchtet werden, genauso einzustufen, wie ganz normal gezüchtete Tierrassen.
Foto oben: Texelschafe aus der Zucht von Heinz Plüss, dem ich für das Foto und seine kundigen Informationen bestens danke.
Diskussion / Kommentare
 Kommentare werden geladen…
Kommentare werden geladen…
Themen
Von: Gerhart Ryffel
Prof. Dr. Gerhart U. Ryffel leitete bis 2011 die Arbeitsgruppe Entwicklungsbiologie des Instituts für Zellbiologie (Tumorforschung) am Universitätsklinikum Essen. 2012 schrieb er für den Synthesebericht des Schweizer Nationalen Forschungsprogrammes “Nutzen und Risiken der Freisetzung gentechnisch veränderter Pflanzen” einen Beitrag zu biogenen Pflanzen.