Tierzucht: Genome Editing ist die bessere Gentechnik
Auch wenn die ersten gentechnisch veränderten Schafe und Schweine schon 1985 auf die Welt kamen - in der praktischen Nutztierzucht spielt die Gentechnik bislang kaum eine Rolle: Zu ineffektiv, fehleranfällig und gesellschaftlich kaum akzeptiert. Mit den neuen Genome Editing-Verfahren wie der Gen-Schere CRISPR könnte sich das ändern.
Um mit klassischer Gentechnik neue, auch „artfremde“ Gene in das Erbgut von Tieren einzuführen, gibt es verschiedene Techniken, die wichtigste ist die Mikroinjektion.
Dazu werden einem Tier frisch befruchtete Eizellen (Zygoten) entnommen. Noch bevor die Kerne des Spermiums und der Eizelle verschmelzen, spritzt man die fremde DNA - ein Genkonstrukt mit der Bauanleitung für das zusätzliche Merkmal - mit einer sehr feinen Glaskapillaren in einen der Zellkerne. Bei der Verschmelzung der Kerne kann auch das Fremdgen an einer zufälligen Stelle in das Genom eingebaut werden. Die sich entwickelnden Embryonen werden dann in Leihmuttertiere eingeführt.
Die Methode ist jedoch ungenau, die Erfolgsrate gering: Je nach Tierart entwickeln sich nur zwei bis 15 Prozent der mikroinjizierten Zygoten zu lebenden Tieren, die auch das gewünschte Merkmal tragen. Zudem sind diese Tiere oft krank und nicht fortpflanzungsfähig. Anders als in der Medizin (Tiermodelle) sind bei Nutztieren Gentechnik-Anwendungen kaum aus dem Projektstadium herausgekommen.
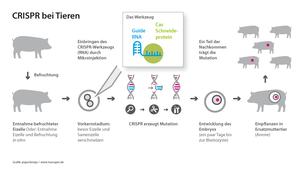
Genome Editing: CRISPR bei Tieren. Hier am Beispiel von Schweinen. Bei Rindern werden editierte Zellen auch geklont, um daraus genetisch identische Nachkommen zu erhalten.
Inzwischen haben die neuen Genome Editing-Verfahren die klassische Gentechnik in der molekularbiologischen Tierzucht abgelöst. Ihr Vorteil: anders als bei der herkömmlichen Gentechnik, bei der nicht zu steuern ist, wie und wo im Genom das neue Gen eingebaut wird, nutzt Genome Editing molekulare, meist zelleigene Werkzeuge, um an einer vorher bestimmten Stelle einzelne DNA-Bausteine auszuschalten oder zu modifizieren
Das heute am weitesten verbreitete Genome Editing-Verfahren ist das CRISPR/Cas-System. Es besteht aus einem RNA-Fragment (CRISPR), welches gezielt DNA-Sequenzen erkennt, und einem Protein (Cas9), welches den DNA-Doppelstrang an dieser Stelle schneidet. Mit Hilfe der zelleigenen Reparaturmechanismen wird der DNA-Strang an der jeweiligen Bruchstelle wieder „geflickt“. Dabei entstehen Fehler oder Abweichungen, ganz ähnlich wie bei einer natürlichen Mutation, jedoch nicht zufällig und unkontrolliert, sondern ganz gezielt. Mit CRISPR/Cas ist es auch möglich, einen DNA-Abschnitt oder ein einzelnes Nukleotid einzufügen, auszutauschen oder auszuschneiden. Dabei ist das System schnell und einfach anwendbar, präzise und kostengünstig.
Andere Genome Editing-Verfahren arbeiten ähnlich, sind aber vor allem schwieriger herzustellen und teurer. Daher rücken sie zunehmend in den Hintergrund. Dazu zählen zum Beispiel TALEN oder Zinkfingernukleasen. Das Prinzip ist immer gleich: Diese Enzyme erkennen - wie auch das CRISPR/Cas-System - spezifisch die gewünschten DNA-Sequenzen und lösen dort einen Bruch des DNA-Doppelstrangs aus.
Die wissenschaftlichen Herausforderungen, Genome Editing in der Tierzüchtung einzusetzen, liegen nicht so sehr in dem Verfahren, sondern darin, geeignete Ziele zu finden. Um ein bestimmtes Merkmal - etwa eine Resistenz gegen Krankheitserreger oder ein besseres Muskelwachstum - verändern zu können, müssen die jeweils verantwortlichen Gene und ihre Funktion in den komplexen genetischen Netzwerken genau bekannt sein. Dafür ist viel Genomforschung erforderlich.
Um aus erfolgreich editierten Zellen lebensfähige Tiere zu erhalten, gibt es derzeit zwei verschiedene Vorgehensweisen:
(1) Die Gen-Editierung wird direkt an der befruchteten Eizelle durchgeführt. Dafür werden Eizellen außerhalb des Tieres befruchtet (in vitro-Fertilisation). Bevor die Kerne des Spermiums und der Eizelle miteinander verschmelzen (Vorkernstadium), wird das jeweilige Werkzeug (CRISPR/Cas-System oder Nuklease) durch Mikroinjektion oder Elektroporation in die Zelle eingebracht. Da das Werkzeug direkt als RNA eingeschleust wird und keine zusätzlichen Vektoren (Genfähren) erforderlich sind, gelangt auch keine Fremd-DNA in die Empfängerzelle.
Nach wenigen Tagen, wenn sich die Eizelle zur sogenannten Keimblase (Blastozyste) entwickelt hat, wird diese in den Eileiter von Ersatzmuttertieren eingebracht und von diesen ausgetragen. Bei den Nachkommen wird untersucht, ob sie die gewünschte Mutation tatsächlich aufweisen. Erfolgreich editierte Tiere werden dann für die Weiterzucht ausgewählt. Meist ist das Editierwerkzeug so effizient, dass beide Allele des Zielgens mutiert sind und die Genveränderung homozygot vorliegt.
Bei Rindern hat man die Möglichkeit, bereits frühen Embryonen eine Zellprobe zu entnehmen (Biopsie), noch bevor sie in Ersatzmuttertiere implantiert werden. Bis untersucht ist, ob die gewünschte Gen-Editierung vorhanden ist, bleiben die Embryonen eingefroren. Die erfolgreich editierten Embryonen werden dann in Leihmütter eingebracht. Bei Schweinen funktioniert dieses Verfahren allerdings nicht, da sich Schweineembryonen wegen ihres hohen Lipidgehalts nicht gut einfrieren lassen.
(2) Man editiert Tierzellen wie z.B. Fibroblastenzellen. Die editierten Zellen verwendet man dann zum Klonen, das heißt man erzeugt mit diesen Zellen genetisch identische „Kopien“ des Tieres. Der Vorteil bei diesem Verfahren ist, dass bereits in den Zellen die erfolgreiche Genome Editierung überprüft werden kann, so dass die herangezogenen Tiere tatsächlich auch die gewünschte Mutation aufweisen.
Themen
Im Web
- Tait-Burkard C. et al. (2018): Livestock 2.0 – genome editing for fitter, healthier, and more productive farmed animals. Genome Biology 19:204
- Monitoring Bericht des BVL, JKI und FLI zu Neuen Molekularen Techniken, Anlage 5: Übersicht über Nutztiere, die mittels Gentechnik und neuer molekularbiologischer Techniken für die Bereiche Ernährung, Landwirtschaft, Heimtiere, Arzneimittelherstellung und -forschung erstellt wurden, 07.06.2018
- Mehta P. et al. (2017): Transgenesis in farm animals-A review. Agricultural Reviews 38(2): 129-136
- Bhat S.A. et al. (2017): Advances in genome editing for improved animal breeding: A review. Vet World 10(11): 1361–1366