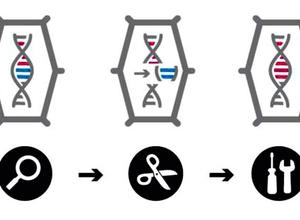
Nobelpreis 2020. Was man zur Gen-Schere CRISPR/Cas wissen sollte
CRISPR/Cas9 – dieses merkwürdige Kürzel steht für ein grundsätzlich neues Verfahren, um einzelne DNA-Bausteine im Erbgut gezielt verändern zu können, so einfach und präzise wie es bis dahin unvorstellbar war. Obwohl es aus Bakterien stammt, funktioniert die „Gen-Schere“ in nahezu allen lebenden Zellen und Organismen: Sie verspricht neue Möglichkeiten gegen Aids, Krebs und eine Reihe von Erbkrankheiten – aber auch bei der Züchtung von Pflanzen und Tieren. Emmanuelle Charpentier und Jennifer Doudna, zwei Molekularbiologinnen, erhielten 2020 dafür den Chemie-Nobelpreis. Doch Europa tat sich lange Zeit schwer, die sich eröffnenden Chancen zu nutzen.
CRISPR/Cas9 (eine Erläuterung des komplizierten Namens gibt es hier) ist eine neue, molekularbiologische Methode, um den DNA-Strang des Erbguts an einer vorbestimmten Stelle gezielt zu schneiden und ihn anschließend genau dort zu verändern. Auf diese Weise können einzelne Gene – genauer: DNA-Bausteine – umgeschrieben oder „editiert“ werden. Gegenüber ähnlichen, aber deutlich komplizierteren Genome Editing-Verfahren wie Zinkfinger-Nukleasen oder TALEN hat sich CRISPR/Cas – oft auch: Gen-Schere – als Standard durchgesetzt. In der Europäischen Union werden sie inzwischen unter dem Oberbegriff Neue genomische Techniken (NGT) zusammengefasst.

Jennifer Doudna und Emmanuelle Charpentier, die beiden „Erfinderinnen“ des CRISPR/Cas-Verfahrens, sind inzwischen gefeierte, mit Preisen überhäufte Popstars der Wissenschaft. 2020 erhielten die den Nobelpreis für Chemie. (Foto: Verleihung des Breakthrough Prize for Life Sciences 2015).
Fotos: Breakthrough Prize; MIT. Oben: Nobel Media / Niklas Elmehed
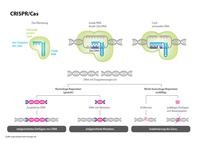
Gezielte Mutation in drei Schritten. Das CRISPR/Cas-System besteht aus einer molekularen „Sonde“ (Guide RNA), die im Genom genau die zu verändernde Zielstelle findet, und einer „Schere“ (Cas9-Protein), welche den DNA-Doppelstrang dort durchtrennt. Anschließend wird er durch zelleigene Reparaturmechanismen wieder zusammengefügt: Im Regelfall gehen dabei einzelne DNA-Bausteine verloren oder sie werden fehlerhaft „geflickt“ (unten rechts). Die Folge: Das betreffende Gen kann nicht mehr richtig abgelesen werden und wird so blockiert. Möglich ist auch, bei der Reparatur des Bruchs dort einzelne DNA-Bausteine nach einer Vorlage auszutauschen oder sogar eine neue Gen-Sequenz einzufügen. (links).
Eigentlich stammt das CRISPR/Cas-System aus Bakterien. Es dient ihnen als eine Art Immunsystem, mit dem sie „feindliche“ Viren anhand zuvor gespeicherter DNA-Fragmente erkennen und abwehren können. Erst nach einigen zufälligen Entdeckungen und jahrelanger Grundlagenforschung wuchs allmählich das Verständnis, wie dieser komplexe Mechanismus funktioniert und was er bewirkt. 2012 hatten zwei Wissenschaftlerinnen – die späteren Nobelpreis-Trägerinnen Jennifer Doudna und Emmanuelle Charpentier – die geniale Idee, diesen speziellen CRISPR-Mechanismus als universales molekularbiologisches Werkzeug zu nutzen. Überraschenderweise funktioniert es nicht nur bei Bakterien, sondern bei allen lebenden Zellen – in menschlichen, aber auch in denen von Tieren und Pflanzen.
Im Kern laufen CRISPR und andere Genome Editing-Verfahren in drei Schritten ab (siehe Kasten links): Zunächst muss im riesigen Genom – das oft aus Milliarden Basenpaaren besteht – genau die Stelle gefunden und angesteuert werden, bei der einzelne DNA-Bausteine verändert werden sollen. Dazu konstruiert man eine molekulare „Sonde“. Beim CRISPR-Verfahren besteht sie aus einem kurzen RNA-Strang (auch Guide RNA genannt), der genau der DNA-Sequenz am Zielort entspricht. Wenn die Sonde diese „gefunden“ hat, dockt sie dort an, um den DNA-Doppelstrang exakt an dieser Stelle mit einer molekularen „Schere“ zu durchschneiden – bei CRISPR ist es das Cas9-Protein, das an die RNA-Sonde gekoppelt ist.
Anschließend treten die zelleigenen Reparatursysteme in Aktion: Sie flicken den durchtrennten DNA-Strang wieder zusammen, allerdings meist mit kleinen „Fehlern“, etwa einer zufällig veränderten Reihenfolge der DNA-Bausteine. Deswegen kann das betreffende Gen nicht mehr richtig abgelesen werden, das entsprechende Genprodukt – ein bestimmtes Protein wird nicht mehr gebildet. Möglich ist auch, nach dem Schnitt im Zuge der Reparatur der Bruchstelle einzelne DNA-Bausteine auszutauschen oder auch kurze Sequenzen neu in den DNA-Strang einzubauen.
Der grundlegende Mechanismus – das Herbeiführen eines Doppelstrangbruchs und seine anschließende Reparatur – ist derselbe wie bei jeder zufälligen natürlichen Mutation. Auch die Mutationszüchtung nutzt genau diese Vorgänge. Nur sind es da Bestrahlung oder Chemikalien, die solche Brüche herbeiführen – allerdings völlig unkontrolliert und in großer Zahl. Der Unterschied: Mit der Gen-Schere CRISPR geschieht es präzise nur an einer einzigen vorbestimmten Stelle im Genom – genau an der, die für zu verändernde Eigenschaft verantwortlich ist.
Gibt es bei CRISPR & Co ähnliche Risiken wie bei der Gentechnik?
Die Gen-Schere CRISPR und andere NGT-Verfahren verringern die Komplikationen, die aus den Zufälligkeiten der Züchtung erwachsen. Das bedeutet Zeit- und Kostenersparnis, aber auch mehr Sicherheit und Kontrolle durch mehr Präzision. Jede Züchtung verändert Gene, aber nur bei den neuen Genome Editing-Verfahren sind diese Veränderungen im Einzelnen bekannt – damit unterscheiden die sich grundlegend von der herkömmlichen Züchtung, aber auch von der Gentechnik.
Bei der klassischen Gentechnik ist es vom Zufall abhängig, an welcher Stelle im Genom einer Pflanze das neue, zusätzliche Gen integriert wird – und in wieviel Kopien. Zudem werden aus technischen Gründen noch weitere Elemente, etwa Start- und Stoppsignale oder Regulatoren (Genkonstrukt) benötigt, die zusammen mit dem Gen übertragen werden müssen. Daraus leiten Kritiker ein grundsätzliches Risiko der Gentechnik ab: Der ungezielte Einbau des „fremden“ Gens an irgendeiner, im einzelnen unbekannten Stelle im Genom kann andere Gen-Funktionen beeinträchtigen und möglicherweise so die Eigenschaften einer Pflanze nachteilig verändern.
Solche „unbeabsichtigten Nebenwirkungen“ sind ein wesentlicher Grund dafür, dass für gentechnisch veränderte (gv-) Pflanzen in fast allen Ländern der Welt Zulassungsverfahren vorgeschrieben sind. Die Hersteller müssen die Sicherheit ihrer Produkte nachweisen, bevor sie auf den Markt kommen. Bisher hat dieses seit mehr als 30 Jahren praktizierte Konzept gut funktioniert. Die Zulassungsverfahren für gv-Pflanzen sind jedoch so zeit- und kostenintensiv, dass sie nur noch von großen internationalen Konzernen zu bewältigen sind.
Ein solches „Risiko“ zufälliger oder unbeabsichtigter Veränderungen gibt es bei editierten Pflanzen kaum. Zwar ist es durchaus möglich, dass das CRISPR/Cas-System den DNA-Strang ungewollt an einer falschen Stelle schneidet. Doch solche off Target-Effekte sind eigentlich nichts anderes als eine weitere zufällige Mutation, wie sie bei jeder natürlicher Vermehrung und Fortpflanzung in großer Zahl stattfindet. Je nach Umweltbedingungen kommt auf je 150 Millionen Basenpaare (DNA-Bausteine) eine Mutation. Das bedeutet: Eine Kartoffelpflanze unterscheidet sich von der nächsten durch sechs Mutationen, bei Weizen mit seinem ungewöhnlich großen Genom sind es sogar 100 Mutationen.
Bei der Mutationszüchtung (Mutagenese), seit Jahrzehnten praktiziert und selbst im Öko-Landbau akzeptiert, wird die Mutationsrate durch Chemikalien oder Strahlung um das 1000fache erhöht. Das ergibt etwa 100.000 zusätzliche Mutationen bei Weizen, 4000 bei Reis – alle zufällig und im einzelnen unbekannt. Eine besondere Sicherheitsbewertung für Pflanzen aus Mutationszüchtung gibt es in keinem Land auf der Welt.
Dennoch will man off-Target-Effekte – unbeabsichtigte Mutationen – bei CRISPR-Anwendungen möglichst vermeiden. Inzwischen wurden die molekularen Werkzeuge – CRISPR-Sonden und vor allem verschiedene Varianten der Schneidewerkzeuge (Nukleasen) – weiterentwickelt und ihre Zielgenauigkeit noch einmal deutlich verbessert. Und: Je länger eine RNA-Sonde (Guide RNA) angelegt ist, mit der die jeweilige Zielregion im Genom aufgespürt wird, um so unwahrscheinlicher ist es, dass genau diese Sequenz zufällig noch einmal im Genom vorhanden ist. Nur wenn die Sonden-RNA mit Abschnitten im Genom genau übereinstimmt, kann es dort zu Fehlschnitten kommen.
„Keine Gentechnik durch die Hintertür“ – Sind solche Warnungen gegen CRISPR und NGT-Verfahren gerechtfertigt?
Organisationen und Aktionsgruppen, die von Anfang ab die klassische Gentechnik bei Pflanzen grundsätzlich abgelehnt haben, wollen auch die neuen Verfahren verhindern. „Gentechnik strikt regulieren“, fordern sie und werfen damit alte Gentechnik und neue Gen-Schere in den gleichen Topf – obwohl sich beide fundamental voneinander unterscheiden. Die seit vielen Jahren unverändert wiederholte Pauschal-Einwände gegen Gentechnik werden einfach auf CRISPR-Pflanzen übertragen. Mit ihnen seien „große Risiken für Mensch, Tier und Umwelt verbunden“. Das Vorsorgeprinzip gebiete es, „Maßnahmen zum Schutz von Umwelt und menschlicher Gesundheit zu ergreifen“.
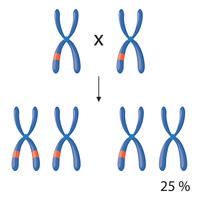
Ausmendeln. Unter den Nachkommen von zwei Pflanzen mit gentechnisch eingefügten CRISPR-Werkzeugen (rot) sind nach den Mendelschen Erbregeln ein Viertel „transgen-frei“ (unten rechts). Mit diesen wird weitergearbeitet.
Grafik: pigurdesign/ www.transgen.de
Zwar werden die für das Editieren erforderlichen CRISPR-Werkzeuge – Guide-RNA und Cas-Schneideproteine – bisher meist mit gentechnischen Verfahren in eine Pflanzenzelle eingeführt. Wenn sie jedoch dort ihren Zweck erfüllt und die beabsichtigte Mutation ausgelöst haben, werden sie nicht mehr benötigt und in der Zelle abgebaut.
Das zuvor eingeführte Genkonstrukt mit der „Bauanleitung“ für die CRISPR-Werkzeuge unterliegt den Vererbungsgesetzen: Nach der Vermehrung ist es in einem Viertel der Nachkommen nicht mehr vorhanden. Diese Pflanzen sind erfolgreich editiert, enthalten aber keine von außen eingeführte Gene. Sie sind überprüfbar „transgen-frei“. Nur mit diesen Pflanzen wird weitergearbeitet, etwa um damit eine neue Sorte zu züchten und zu vermehren. In deren Saatgut ist dann nur das neue, editierte Merkmal vorhanden – zum Beispiel eine Resistenz gegen Pilzkrankheiten – und wird bei jeder weiteren Vermehrung weitergegeben. DNA-Spuren, die eindeutige Rückschlüsse auf das genutzte Verfahren zulassen, gibt es nicht. Daher ist ein analytischer Nachweis, ob das Merkmal aus herkömmlicher Züchtung stammt, oder mit der Gen-Schere hineineditiert wurde, nicht möglich. (Mehr dazu im transGEN-Video CRISPR bei Pflanzen: Zum Beispiel Weizen)
Zudem entwickelt sich die Technologie rasch weiter. Neue DNA-freie Verfahren schaffen es, die für ein neues Merkmal verantwortlichen DNA-Bausteine direkt zu editieren. Sie kommen ohne den Umweg aus, ein für die CRISPR-Operation erforderliches Genkonstrukt gentechnisch einführen zu müssen. Künftig könnten RNA-Sonde und Schneideprotein auch mit Nanopartikeln in die Pflanzenzelle transportiert werden – ganz ohne Gentechnik. (Prime Editing, Base Editing)
CRISPR ist gezielte Mutation, keine „Neue Gentechnik“
In den einfachen Varianten (NGT1) führt Genome Editing zu Pflanzen mit punktuellen Veränderungen einzelner DNA-Bausteine – wie sie auch zufällig, ohne jeden technischen Eingriff unter natürlichen Bedingungen entstehen können. Am Ende ist in den editierten Produkten – etwa Saatgut – kein fremdes, von außen eingeführtes Gen-Material vorhanden. Anders als gentechnisch veränderte Pflanzen sind sie „transgen-frei“.
Dennoch entschied der EuGH (Europäische Gerichtshof) am 25. Juli 2018, dass die neuen Genome Editing-Verfahren als Gentechnik anzusehen sind und den gleichen Zulassungs- und Kennzeichnungsvorschriften unterliegen wie gentechnisch veränderte Organismen (GVO). Grundlage des Urteils war eine rein juristische Interpretation des bestehenden EU-Gentechnikrechts. Doch das ist im Kern mehr als 30 Jahre alt und stammt aus einer Zeit, als auch in der Wissenschaft sich niemand Verfahren wie die Gen-Schere CRISPR vorstellen konnte.
Über Jahre legten wissenschaftlich überholte Gesetze noch immer die Bedingungen fest, unter denen Verfahren der gezielten Mutagenese wie CRISPR&Co angewandt werden müssen. De facto wirken sie als Verbote: Die teuren, aufwändigen Zulassungsverfahren nach Gentechnik-Recht sind für Forschungsreinrichtungen oder kleine Unternehmen kaum zu erfüllen. Gerade angepasste Züchtungen, die auf regionale klimatische Bedingungen und Krankheiten reagieren, werden damit verhindert. Spezielle gentechnik-spezifische Auflagen machen Anbau und Vermarktung in Europa unwirtschaftlich. Zudem müssten genom-editierte Pflanzen und Produkte als „gentechnisch verändert“ gekennzeichnet werden – was nicht nur wissenschaftlich falsch ist, sondern das Negativ-Image der Gentechnik auf die neuen Verfahren überträgt.
Zahlreiche Länder außerhalb der EU haben NGT-Pflanzen bereits aus dem alten Gentechnik-Recht herausgenommen Einige gehen fallweise vor, andere geben einfache editierte Pflanzen ohne „fremdes“ DNA-Material generell frei. In den USA sind bereits zahlreiche editierte Pflanzen, die sich derzeit in der Entwicklung befinden, als „nicht-GVO“ klassifiziert worden, etwa Weizen, Sojabohnen, Kartoffeln, Mais, Bananen, Orangen oder Tomaten mit verschiedenen neuen Merkmalen. Weder bei Freilandversuchen, noch im Falle eines kommerziellen Anbaus gelten für diese Pflanzen besondere Regeln.
Alle großen Wissenschaftsorganisationen haben sich für eine Überarbeitung der veralteten GVO-Definition ausgesprochen. Sie empfehlen, genom-edierte Pflanzen dann von den Gentechnik-Vorschriften auszunehmen, wenn keine artfremde genetische Information eingeführt wurde und die Veränderung sich auch natürlich-zufällig oder durch herkömmliche Züchtung hätte ergeben können. An diesem Grundsatz orientiert sich auch der Vorschlag für eine „Verordnung über mit bestimmten neuen genomischen Techniken gewonnene Pflanzen“, den die EU-Kommission in den komplizierten europäischen Gesetzgebungsprozess eingebracht hat.
Inzwischen haben EU-Parlament (Februar 2024) und die Mitgliedstaaten (März 2025) zugestimmt, wenn auch mit zahlreichen Änderungswünschen. Im Dezember 2025 haben Rat und Parlament im Trilog-Verfahren eine gemeinsame Fassung ausgehandelt. Wenn dieser Kompromiss hält, könnte die neue EU-Verordnung Mitte 2026 in Kraft treten.
Diskussion / Kommentare
 Kommentare werden geladen…
Kommentare werden geladen…
Themen
Nobelpreisträgerin Emmanuelle Charpentier im Gespräch mit Mai Thi Nguyen-Kim (in engl. Sprache)
Im Web
- The Nobel Prize: The Nobel Prize in Chemistry 2020
- EU-Kommission, New techniques in biotechnology
- EU-Kommission; Vorschlag für eine VERORDNUNG DES EUROPÄISCHEN PARLAMENTS UND DES RATES über mit bestimmten neuen genomischen Techniken gewonnene Pflanzen und die aus ihnen gewonnenen Lebens- und Futtermittel
- Leopoldina und DFG fordern wissenschaftsbasierte Positionierung in der EU-Debatte um neue genomische Techniken in der Pflanzenzucht; 19.10.2023
- Leopoldina, DFG, Union der deutschen Akademien der Wissenschaft; Wege zu einer wissenschaftlich begründeten, differenzierten Regulierung genomeditierter Pflanzen in der EU (2019)
- Neue Züchtungstechniken in der Pflanzenzüchtung, DLG-Merkblatt 468