Von der Krebsmaus zum menschlichen Schweineherzen
Anders als in der Landwirtschaft gibt es gentechnisch veränderte Tiere in der Medizin schon lange. Vor mehr als dreißig Jahren wurde die erste Krebsmaus patentiert. Inzwischen gibt es spezielle Arzneimittel gegen seltene Erbkrankheiten aus transgenen Tieren, und Schweine liefern menschliche Organe. Anfang 2022 wurde zum ersten Mal ein Schweineherz in einen Menschen transplantiert, 2024 erstmals eine Schweineniere.

Gentechnisch veränderte Ziegen produzieren
einen Wirkstoff, der Blutgerinsel hemmt (Antithrombin). Das ist weitaus effektiver als ihn aus menschlichem Blut zu
gewinnen.
Fotos: GTC, iStock (großes Foto oben)
Bereits 1984 wurden an der Harvard Universität (USA) erstmals gezielt bestimmte Gene in Mäuse eingeführt - mit dem Ziel, ihre Anfälligkeit für bestimmte Tumore zu erhöhen. So veränderte Mäuse dienen auch heute noch als „Tiermodelle“, an dem kanzerogene Substanzen und Arzneistoffe gegen Krebserkrankungen getestet werden.
Fester Bestandteil der medizinischen Grundlagenforschung sind auch sogenannte Knockout-Tiere. Bei ihnen wird mittels Gentechnik ein bestimmtes Gen ausgeschaltet oder zerstört, um die Funktion des inaktivierten Gens am lebenden Tier untersuchen zu können.
Gene Pharming: Wirkstoffe aus Tieren
Doch nicht nur in der Grundlagenforschung finden transgene Tiere Verwendung. Forschungsgruppen und Unternehmen arbeiten daran, Tiere wie Ziegen, Schweine, Kaninchen und Kühe so zu verändern, dass sie in bestimmten Geweben medizinische Wirkstoffe bilden. Dieser Bereich der Gentechnik, auch Gene Pharming oder Molecular Farming genannt, umfasst die Verwendung transgener Tiere (und Pflanzen) zur Produktion von medizinischen und industriellen Substanzen. In der Regel handelt es sich dabei um Proteine.
Der Einsatz von Tieren zur Gewinnung von Arzneimitteln ist nichts Neues. Bis in die 1940er Jahre gewann man Kortison aus den Nebennieren von Rindern. Insulin für Diabetiker wurde bis Mitte der 1980er aus tierischem Gewebe isoliert. Der Gerinnungshemmer Heparin stammt bis heute aus Schweinedärmen.
Mit der Gentechnik haben sich auch hier die Möglichkeiten erweitert. Damit kann man die Erbinformation für die gewünschten Substanzen auf Tiere übertragen und diese dann als Produktionsplattform nutzen. Für bestimmte Wirkstoffe ist die Herstellung in Tieren oft wirtschaftlicher als mit Hilfe von Mikroorganismen oder in Zellkulturen, vor allem, wenn nur sehr geringe Mengen benötigt werden wie etwa bei monoklonalen Antikörpern. Zunehmend kommen beim Gene Pharming auch die neuen Genome Editing-Verfahren zum Einsatz. Mit ihnen sind die erforderlichen punktuellen Veränderungen im Erbgut der Tiere einfacher und präziser möglich als mit der herkömmlichen Gentechnik.
Im Jahr 2008 kam das erste Arzneimittel aus transgenen Tieren auf den Markt, auch in Deutschland: Antithrombin III, kurz ATryn. Es hemmt die Blutgerinnung und soll Menschen mit einem erblich bedingten Antithrombinmangel bei Risikooperationen vor lebensgefährlichen Thrombosen schützen. Die Firma rEVO Biologics (ehemals GTC Biotherapeutics) hat die genetische Information für Antithrombin in das Genom von Ziegen eingeführt. Ein entsprechender Promotor vor dem Gen sorgt dafür, dass das Eiweiß nur in der Milchdrüse gebildet wird.
Inzwischen sind noch weitere Medikamente erhältlich, deren Wirkstoffe in gv-Tieren produziert werden. Dazu gehört etwa Ruconest (Conestat alfa) des niederländischen Unternehmens Pharming Group, das zur Behandlung des Hereditären Angioödems (HAE), einer seltenen Erbkrankheit, eingesetzt wird. Das Arzneimittel enthält ein Plasmaprotein, welches in der Milchdrüse von gv-Kaninchen gebildet wird.
Das Medikament Kanuma der US-amerikanischen Firma Alexion Pharmaceuticals hilft Patienten, die unter einem Mangel des Enzyms Lysosomale Saure Lipase (LAL-d) leiden, einer sehr seltenen Erbkrankheit. Kanuma besteht aus einem Protein (Sebelipase alfa), das aus dem Eiklar transgener Hühner gewonnen und zur Enzymersatztherapie eingesetzt wird.
Ein Forschungsteam aus Brasilien und den USA hat transgene Kühe gezüchtet, deren Milch Proinsulin und Insulin enthält. Damit könnte in Zukunft Menschen geholfen werden, die unter Diabetes leiden und regelmäßig Insulin spritzen müssen. Eine Reihe weiterer Proteine, die in der Milch transgener Tiere produziert werden und bei verschiedenen Krankheiten helfen sollen, befinden sich in der Testphase. Mit einigen werden bereits klinische Studien durchgeführt.
Organe für Schwerkranke - aus modifizierten Schweinen
Der Bedarf an Spenderorganen ist bei weitem höher als das Angebot. Daher wird seit Jahren intensiv an der Xenotransplantation geforscht – der Übertragung von Zellen, Geweben oder Organen zwischen nicht verwandten Arten, wie vom Tier auf den Menschen.
Das Hausschwein eignet sich dafür besonders gut, da die Organe von Schweinen und Menschen in etwa die gleiche Größe und ähnliche anatomische und physiologische Merkmale haben. Damit die Xenotransplantation überhaupt erfolgreich sein kann, sind eine Reihe von Schwierigkeiten zu überwinden.
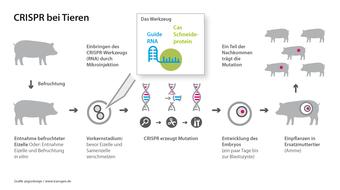
Das Hauptproblem ist die immunologische Abstoßungsreaktion: Wird das Organ eines Schweins in den menschlichen Körper übertragen, reagieren Antikörper auf die Antigene an der Oberfläche des Fremdkörpers. Das Abwehrsystem im Blut wird aktiviert und zerstört das Organ. Mithilfe der Gentechnik versucht man dies zu verhindern. Dabei wird heute zunehmend die Gen-Schere CRISPR/Cas eingesetzt, vor allem um die Oberflächenantigene so zu verändern, dass sie beim Menschen keine Abstoßungsreaktion mehr auslösen.
Schon vor ein paar Jahren war es gelungen, mit CRISPR/Cas über 20 Gene in Schweineembryonen gleichzeitig zu modifizieren. Die darin codierten Proteine sitzen auf der Zelloberfläche und lösen die menschliche Immunabwehr aus bzw. verursachen die Blutgerinnung.
Ein Forschungsverbund unter deutscher Beteiligung hatte 2016 ein Schweineherz in einen Affen transplantiert, der damit zwei Jahre lebte. Das transgene Schwein trug auf der Oberfläche der Blutgefäßzellen bestimmte menschliche Proteine (Thrombomodulin), sodass das Blut des Affen keine Blutgerinsel bildete. Eine Abstoßungsreaktion beim Affen wurde durch die Gabe bestimmter Antikörper und Medikamente unterbunden.
Im Januar 2022 wurde erstmals ein Schweineherz in einen Menschen transplantiert. Im Genom des Spenderschweins waren drei Gene ausgeschaltet worden, die eine starke Immunabwehr beim Menschen hervorrufen können. Außerdem war ein Wachstumsgen deaktiviert, so dass das Spenderherz nach der Transplantation nicht weiter wächst. Durch das Einfügen von sechs menschlichen Genen weist das Schweineherz „menschentypische“ Proteine auf, die eine Abwehrreaktion des Immunsystems verhindern sollen. Dem Patienten wurden zusätzlich verschiedene Medikamente verabreicht, um die natürliche Abstoßungsreaktion zu unterbinden.
Ein dauerhafter Erfolg war diese Transplantation nicht. Im März 2022 starb der Patient, nachdem Abstoßungsreaktionen aufgetreten waren. Zusätzlich stellte sich heraus, dass das Schweineherz mit bestimmten Schweineviren (Porcine Cytomegaloviren) infiziert war. Diese befallen zwar nicht menschliche Zellen, wirken aber indirekt auf den menschlichen Körper: Es treten Blutungen und Entzündungen auf, die letztlich zum Organversagen führen.
Im März 2024 transplantierten Mediziner in den USA erstmals eine Schweineniere in einen lebenden Menschen. Da die Niere deutlich komplexer hinsichtlich ihrer Funktionen im Körper ist als das Herz, mussten viel mehr genetische Veränderungen vorgenommen werden (insgesamt 69), damit die Schweineniere im menschlichen Körper ihre Aufgaben erfüllt.
Auch in Deutschland erwartet man in absehbarer Zeit die erste Xenotransplantation. An der Ludwig-Maximilians-Universität München, wo schon seit Jahren intensiv an der Anpassung von tierischen Organen für den Einsatz im Menschen geforscht wird, nutzt man als Spendertiere für menschliche Ersatzherzen nicht Hausschweine, sondern Auckland-Island-Pigs, eine kleinere Schweinerasse, deren Herzen ähnlich groß sind wie die des Menschen. In den Zellen der Schweine wurden drei Gene abgeschaltet und zwei menschliche Gene hinzugefügt. Die modifizierten Schweineherzen sollen zunächst in Pavianen getestet werden, bevor eine Übertragung auf den Menschen durchgeführt werden kann.
Themen
Im Web
- Erstmals Schweineniere in Menschen transplantiert. Süddeutsche Zeitung, 22.03.2024
- Schweineherzen als Lebensretter. ZDF, 07.01.2024
- Monzani P.S. et al. (2024): Human proinsulin production in the milk of transgenic cattle. Biotechnology Journal 19(3)
- Chance Xenotransplantation – Schweineherzen für Menschen? SWR, 02.08.2023
- Xenotransplantation: Mensch bekommt Schweineherz. Scinexx, 12.01.2022
- Xenotransplantation - Forschung für neue Organersatzverfahren. Deutsches Primatenzentrum
- Monitoring Bericht des BVL, JKI und FLI zu Neuen Molekularen Techniken, Anlage 5: Übersicht über Nutztiere, die mittels Gentechnik und neuer molekularbiologischer Techniken für die Bereiche Ernährung, Landwirtschaft, Heimtiere, Arzneimittelherstellung und -forschung erstellt wurden, 07.06.2018
- Transgene Kühe produzieren Grippe-Medikament. Elite, 08.11.2017