Nutztiere: Gentechnik ist passé, aber neuer Schub durch Genome Editing
Gentechnik bei Nutztieren? Lange Zeit hatte das kaum praktische Bedeutung. Es wurde zwar viel geforscht und ausprobiert, doch meist ohne Erfolg. Solche Tiere waren oft krank oder nicht lebensfähig. Mit den neuen Genome Editing-Verfahren wie der Gen-Schere CRISPR/Cas hat sich das grundlegend geändert. Nun ist es möglich, einzelne DNA-Bausteine im Erbgut von Tieren gezielt umzuschreiben und so bestimmte Eigenschaften zu verändern. Dabei geht es um bessere Widerstandsfähigkeit gegen Tierseuchen oder mehr Muskelwachstum. In den USA, Japan und Südamerika sind bereits erste genom-editierte Tiere zugelassen. Weitere werden bald folgen. In Europa dagegen haben sie vorerst wohl keine Chancen.

Makro-Schweine. In den 1990er-Jahre versuchte man, mit Gentechnik das Größenwachstum zu steigern - am Ende erfolglos.
Mikro-Schweine. Chinesische Wissenschaftler wollten die Möglichkeiten der neuen Genome Editing-Verfahren demonstrieren, indem sie gezielt ein Gen für das Größenwachstum umgeschrieben haben - mit Erfolg.
Bereits 1980 gelang es zum ersten Mal, einen neuen, „artfremden“ DNA-Abschnitt in das Genom eines Säugetiers, der Maus, zu integrieren – noch bevor Ähnliches bei einer Pflanze möglich wurde. Dank eines zusätzlichen Wachstumshormon-Gens wuchsen diese transgenen Mäuse schneller und wurden größer als ihre herkömmlichen Artgenossen.
Trotz dieses spektakulären Erfolgs gibt es auch mehr als vierzig Jahre später außerhalb von Laboren und Forschungseinrichtungen keine gentechnisch veränderten (gv-) Nutztiere – mit Ausnahme von größeren Lachsen und Schweinen mit speziellen Veränderungen für Allergiker (GalSafe pigs) in Nordamerika.
Die klassischen gentechnischen Verfahren sind vor allem bei großen Wirbeltieren sehr aufwändig und wenig effizient. Es ist weitgehend vom Zufall abhängig, an welcher Stelle ein neues Gen in das jeweilige Tier-Genom eingebaut wird und wie sich der Integrationsort auf andere Genfunktionen auswirkt. Meist sind viele Versuche notwendig, bis sich tatsächlich eine veränderte Zelle zu einem Embryo oder gar zu einem lebenden Tier entwickelt. Diese Tiere sind dann oft krank oder nicht fortpflanzungsfähig. Mit wenigen Ausnahmen hat sich die Gentechnik in der praktischen Tierzucht nicht etablieren können. Doch das hat sich inzwischen gründlich geändert.
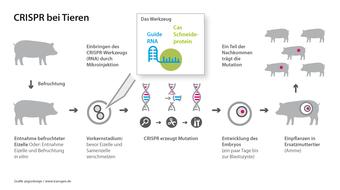
Auch in der Tierzucht haben neue, molekularbiologische Methoden Einzug erhalten: Mit den Genome Editing-Verfahren wie der Gen-Schere CRISPR/Cas können gezielt einzelne DNA-Bausteine (Basen) im Erbgut umgeschrieben, abgeschaltet oder gegen neue ausgetauscht werden. Bei den Nachkommen der Tiere sind dann lediglich diese DNA-Sequenzen verändert, ähnlich wie bei einer natürlichen Mutation. Die neuen Verfahren sind viel genauer, kontrollierter und nicht mehr so stark vom Zufall abhängig – und damit auch sicherer als die klassische Gentechnik. Nebeneffekte durch unbeabsichtigte Veränderungen im Genom der Tiere – oft verbunden mit Leid und Krankheit – sind bei Genome Editing weitaus seltener.
Doch so einfach die neuen Techniken auch scheinen – sie setzten viel Wissen voraus. Denn zunächst müssen im riesigen Genom der Tiere genau jene Gene identifiziert werden, welche für die Ausprägung eines bestimmten Merkmals verantwortlich sind. Oder die eine wichtige Rolle dabei spielen, ob ein Tier gegen Krankheitserreger mehr oder weniger empfindlich ist. Erst dann können diese Abschnitte gezielt verändert oder das entsprechende Gen ausgeschaltet werden.
Meist ist jedoch mehr als ein Gen an der Ausprägung einer Eigenschaft verantwortlich. Um die oft komplexen molekularen und genetischen Zusammenhänge dahinter zu verstehen, ist viel systematische Genomforschung erforderlich. In den letzten Jahren ist eine Menge passiert: Die Genome der wichtigsten Nutztiere sind bereits entschlüsselt, die Funktion wichtiger Gene und die beteiligten genomischen Netzwerke werden immer besser verstanden – auch dank immenser Fortschritte bei Labortechniken und KI-gestützter Bioinformatik.
Fast zweihundert Forschungsprojekte: Was mit Genome Editing möglich ist
Inzwischen gibt es weltweit einen Boom bei Forschungsprojekte mit genom-editierten Tieren. Nach einem aktuellen, im Auftrag der Europäischen Lebensmittelbehörde (EFSA) erstellten Bericht sind bereits 195 wissenschaftliche Publikationen zu Genom-Editierungen bei Tieren erschienen, die weitaus meisten in China (56 Prozent), vor den USA und Japan. 59 Prozent der Projekte beschäftigten sich mit Säugetieren, vor allem Schweinen und Rindern, 29 Prozent mit Fischen und 8 Prozent mit Geflügel. Knapp ein Drittel zielen darauf ab, die Fleischausbeute zu erhöhen. Andere wichtige Ziele sind eine bessere Widerstandsfähigkeit gegen Infektionskrankheiten und Tierseuchen, eine Steuerung der Reproduktion sowie Anpassung an Hitze und Haltungsbedingungen. Geforscht wird auch daran, einzelne Allergene in tierischen Lebensmitteln auszuschalten. (Stand: September 2023)

Meerbrasse mit stärkerem Muskelwachstum. Weltweit das erste als Lebensmittel zugelassene genom-editierte Tier. (Japan 2021)
Wachstum und mehr Fleisch
Oft geht es auch mit den neuen Verfahren darum, den Fleischertrag bei Nutztieren zu steigern. Ein häufig verfolgtes Konzept zielt darauf, das in vielen Säugetieren und Fischen aktive Gen für das Protein Myostatin auszuschalten, welches normalerweise das Muskelwachstum hemmt. Wird dieses Gen infolge einer Mutation blockiert – gleich ob zufällig in der Natur oder durch die Gen-Schere CRISPR/Cas herbeigeführt –, bilden die Tiere größere Muskeln und liefern so mehr Fleisch.
Entdeckt wurde die Bedeutung des Gens bei alten Landrassen wie den „Weißblauen Belgiern“ (Rinder) oder dem Texel-Schaf. Bei diesen sehr muskulösen Tieren ist das Myostatin-Gen durch natürliche Mutation ausgeschaltet. Inzwischen ist es gelungen, das jeweilige Myostatin-Gen an Schweinen, Kühen, Pferden, Hunden, Kaninchen, Schafen, Ziegen und verschiedenen Fischarten durch Genome Editing zu unterdrücken und so das Muskelwachstum zu stimulieren.
- In Japan ist bereits eine editierte Meerbrasse als Lebensmittel zugelassen, die mehr Fleisch ansetzt als konventionelle Artgenossen, inzwischen auch ein ähnlich editierter Kugelfisch sowie eine schnellwachsende Flunder.
- Eine neue Rinderrasse, bei der das Myostatin-Gen mit Hilfe des TALEN-Verfahrens blockiert wurde, ist in Brasilien und Argentinien bereits als nicht-GVO eingestuft. Deren Fleisch kann ohne Auflagen vermarktet werden. Zusätzlich besitzen diese Rinder ein dünneres, besser für Hitze geeignetes Fell, für das ein bestimmtes Gen mit CRISPR/Cas editiert wurde (siehe unten).

Schweine, resistent gegen das PRRS-Virus. In den USA bereits zugelassen.
Bessere Widerstandsfähigkeit gegen Viruskrankheiten und Tierseuchen
- In den USA und am schottischen Roslin Institut ist es gelungen, in Ferkeln eine Resistenz gegen das PRRS-Virus zu erzeugen, Auslöser für die weltweit bedeutendste Schweinekrankheit. Die Forscher haben dazu ein Gen für ein bestimmtes Protein, das als „Einstiegspforte“ für das Virus dient, mit Hilfe von CRISPR/Cas abgeschaltet. Bei den editierten Tieren fehlt dieses Protein, sie erwiesen sich als „vollständig immun“. – In den USA sind die PRRS-resistenten Schweine bereits zugelassen. Die Markteinführung soll beginnen, wenn sie auch in wichtigen Exportmärkten zugelassen sind. In Brasilien und Kolumbien ist das bereits erfolgt.
- Eine Forschungsgruppe am Friedrich-Loeffler-Institut auf der Ostseeinsel Riems arbeitet daran, Hausschweine resistent gegen die Afrikanische Schweinepest zu machen. Die durch Viren ausgelöste Krankheit breitet sich zunehmend auch in Europa aus. Die Grundidee: Erst wird das Genkonstrukt für eine zu diesem Zweck konstruierte Gen-Schere in Schweinezellen eingefügt. Danach zerschneidet sie die Virus-DNA und schränkt so deren weitere Vermehrung ein.
- Auch gegen die verheerende Vogelgrippe (Avian Flu) eröffnen sich endlich neue Wege, die Seuche einzudämmen. Durch Genome Editing konnte in Hühnerzellen ein bestimmtes Protein modifiziert werden, das die Viren für ihre Vermehrung benötigen. Das Konzept funktioniert – fast alle Hühner mit dem editierten, nur leicht veränderten ANP-32-Protein infizierten sich nicht, als sie dem Erreger ausgesetzt wurden. Allerdings funktionierte die Resistenz nur bei einer geringen Viruslast. – Die Vogelgrippe breitet sich weltweit aus und bedroht nicht nur wild lebende Vogelarten, sondern auch die Geflügelhaltung. Derzeit werden in Betrieben, in die das Virus eingeschleppt wurde, alle Tiere getötet. Auch für Menschen kann das H5N1-Grippevirus gefährlich sein.

Hornlose Rinder. In Argentinien als nicht-GVO eingestuft.
Alternativen zum Enthornen, Kastrieren, Kükentöten
Andere Projekte wollen das Tierwohl verbessern oder Folgen der Nutztierhaltung abmildern.
- In den USA hat eine Forschungsgruppe Rinder entwickelt, die keine Hörner ausbilden. Dazu wurde ein Gen von hornlosen Rinderrassen eingeführt. In der Viehhaltung ist es üblich, Kühe zu enthornen, um die Verletzungsgefahr unter den Tieren und für den Landwirt zu verringern. Das Enthornen der Kälber ist für die Tiere mit Stress und Schmerzen verbunden. Durch die Zucht hornloser Rinder kann dies vermieden werden.
- Auch eine einfache, schmerzfreie Alternative zum Kastrieren von Schweinen könnte mit Genome Editing möglich werden. Männliche Ferkel werden in der Regel nach wenigen Tagen kastriert, um zu verhindern, dass das Fleisch streng riecht oder unangenehm schmeckt („Ebergeruch“). Außerdem lassen sich unkastrierte Schweine wegen ihres aggressiveren Verhaltens schwieriger halten. Zwar ist die betäubungslose Kastration umstritten und in Deutschland seit Januar 2021 verboten, doch andere Lösungen sind kompliziert oder sehr aufwändig. In den USA ist es gelungen, bei Schweinen mit CRISPR/Cas ein Gen auszuschalten, welches bei der Entwicklung der Geschlechtsreife eine Rolle spielt. Die Schweine bleiben in einem vorpubertären Stadium und bilden somit keinen Ebergeruch. Auf eine Kastration kann dann verzichtet werden.
- Inzwischen ist es in Deutschland verboten, die bei Legehuhnrassen „nutzlosen“ männliche Küken zu töten. Doch technische Verfahren, um das Geschlecht der Embryos schon im Ei zu bestimmen, sind kompliziert und teuer. Vor allem liefern sie erst dann Ergebnisse, wenn die Entwicklung der Embryos im Ei schon zu weit fortgeschritten ist. Ein israelisches Startup-Unternehmen (eggXYT) hat mit Hilfe von CRISPR/Cas ein Gen für ein fluoreszierendes Protein in das Genom von Hühnern eingeführt – ausschließlich in deren männlichen Geschlechtschromosom. Mit diesem Biomarker sind die „männlichen Eier“ sofort und einfach zu erkennen. Sie müssen erst gar nicht bebrütet werden.

Rinder mit kurzem Fell, die deswegen weniger hitzeanfällig sind. In den USA zugelassen.
Weidetiere besser an Hitze anpassen
Andere Projekte beschäftigen sich damit, Tiere an veränderte Umweltbedingungen in Folge des Klimawandels anzupassen.
- Die US-Firma Acceligen hat zusammen mit Kooperationspartnern Rinder entwickelt, die als Folge einer durch CRISPR/Cas herbeigeführten Mutation ein kurzes, glattes Fell (Slick haired cattle) besitzen und damit weniger hitzeanfällig sind. Da diese Mutation auch bei anderen Rinderrassen natürlicherweise vorkommt und kein fremdes DNA-Material eingefügt wurde, hat die US-Lebensmittelbehörde FDA (Food and Drug Administration) die Tiere nach langer Prüfung freigegeben, ohne aufwändigen und langwierigen Zulassungsprozess wie er bei gentechnisch veränderten Tieren vorgeschrieben ist. Weder die editierten Rinder, noch ihr Fleisch oder Sperma für die Zucht müssen gesondert gekennzeichnet werden.
- In Neuseeland wurde bei Holstein-Rindern mit CRISPR/Cas ein Pigmentierungs-Gen so „umgeschrieben“, wie es natürlicherweise bei manchen Rinderrassen wie Galloways vorkommt. Nun ist ihr Fell nicht mehr schwarz-gefleckt, sondern silber-grau. Dadurch sollen die Tiere weniger Wärme aufnehmen und so besser mit Hitze und intensiver Sonneneinstrahlung zurechtkommen.
Europa: Unüberwindliche Hürden für genom-editierte Tiere
Ob genom-editierte Tiere auch in Europa einmal auf den Markt kommen, ist jedoch fraglich. Derzeit fallen alle mit Genome Editing-Verfahren erzeugte Organismen unter die geltenden Gentechnik-Gesetze und müssen ein aufwändiges Zulassungsverfahren durchlaufen. Lebensmittel aus genom-editierten Tieren sind als „gentechnisch verändert“ zu kennzeichnen. Kaum vorstellbar, dass solche Produkte in naher Zukunft akzeptiert werden.
Nach dem aktuell Vorschlag der EU-Kommission für eine Reform der Gentechnik-Gesetze sollen zwar einfache genom-editierte Pflanzen ohne Fremdgene, die auch unter natürlichen Bedingungen entstehen könnten, von den meisten Auflagen befreit und nur noch angemeldet werden müssen. Das gilt jedoch nur für Pflanzen, bei genom-editierte Tiere soll es auch in Zukunft keine Erleichterungen geben. Im Gegenteil: Bisher hat es in der EU weder für gentechnisch veränderte, noch für editierte Tiere einen Zulassungsantrag gegeben. Erfahrungen bei der Sicherheitsbewertung und Verfahrensdauer gibt es nicht – weder bei Behörden, noch bei potenziellen Antragstellern.
Großes Foto oben: Genom-editierte Ferkel mit PRRS-Resistenz / Laura Dow/Roslin Institute; Fotos: Bejing Genetic Institute, Archiv i-bio, iStock, Norrie Russel/Roslin Institute, The Cornell Alliance for Science, ABCgenetics
Diskussion / Kommentare
 Kommentare werden geladen…
Kommentare werden geladen…
Themen
Im Web
- New Genomic Techniques (NGT) in animals and their agri/food/feed products; EFSA Journal 2023;20(9):EN-8311. External Scientific Report; Alison L.Van Eenennaam Alba Ledesman, Alison Van Eenennaam; Global Status of Gene Edited Food Animals and their Products
- Gene-edited beef cattle get regulatory clearance in US. AP news, 07.03.2022
- US regulators OK genetically modified pig for food, drugs. AP news, 15.12.2020
- FDA Makes Low-Risk Determination for Marketing of Products from Genome-Edited Beef Cattle After Safety Review; News Release 07 March 2022
- Proudfoot, C. et al. (2020): Livestock breeding for the 21st century: the promise of the editing revolution. Frontiers of Agricultural Science and Engineering 7(2)
- Tait-Burkard, C. et al. (2018): Livestock 2.0 – genome editing for fitter, healthier, and more productive farmed animals. Genome Biology 19(204)
- Hanno Charisius, Genveränderung soll Hühner gegen Vogelgrippe resistent machen; Süddeutsche 10. Okt 2023
- China’s CRISPR push in animals promises better meat, novel therapies, and pig organs for People. Science 31.07.2019
- Zhao, J. et al. (2019): Genome editing in large animals: current status and future prospects. National Science Review
- Recombinetics / Acceligen; Precision Breeding
- Roslin Institute, Genome editing to prevent bird flu
- EFSA, Genetisch veränderte Tiere