Die Präzision der Gen-Schere und die Zufälligkeit von Mutationen. Wie das Vorsorgeprinzip missbraucht wird
Für Pflanzen, die mit neuen Verfahren wie der Gen-Schere CRISPR/Cas entwickelt wurden, sollen weiterhin die gleichen strengen Gesetze gelten wie für die alte Gentechnik. Das fordern nicht nur viele Umwelt- und Verbraucherorganisationen, sondern auch die Regierungsparteien SPD und Grüne. Sie berufen sich dabei auf eine strikte Auslegung des Vorsorgeprinzips. Wissenschaftlich begründet ist das nicht. Gerade die neuen Verfahren sind weitaus präziser als die sogenannte Zufallsmutagenese, für die es keine besondere Auflagen gibt.
Seit dem Sommer 2023 ist es offiziell: Die EU-Kommission will neue Züchtungsverfahren (NGT, neue genomische Techniken) wie die Gen-Schere CRISPR/Cas neu regulieren. Damit gezüchtete Pflanzen, die auch unter natürlichen Bedingungen „von selbst“ entstehen könnten und die kein fremdes Genmaterial enthalten, sollen künftig nur noch angemeldet werden müssen. Allerdings: Mitgliedstaaten und das EU-Parlament müssen noch zustimmen.
Vor allem Parteien und Organisationen, die seit vielen Jahren gegen die herkömmliche Gentechnik zu Felde gezogen sind, lehnen den Vorschlag der Kommission strikt ab. Sie berufen sich dabei auf das in der EU gesetzlich verankerte Vorsorgeprinzip. Es sei „unverhandelbar“, so ein Beschluss der SPD-Bundestagsfraktion (April 2021).
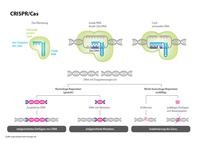
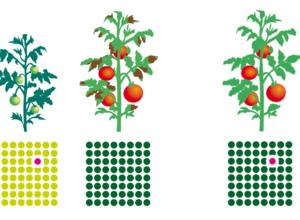
Präzisionszüchtung. Die CRISPR-Sonde (Guide RNA) spürt die Zielsequenz auf. Nur da, wo deren DNA-Abfolge mit der RNA der Sonde übereinstimmt, wird der Erbgut-Strang geschnitten und anschließend repariert - dasselbe passiert bei jeder „natürlichen“ Mutation.
Große Abb. oben: Bing Image Creator, Grafik: Stefan Pigur/i-bio
Der Kommissionsvorschlag setze sich über das Vorsorgeprinzip hinweg und sei daher „rechtswidrig“, so ein von der Grünen Bundestagsfraktion in Auftrag gegebenes Rechtsgutachten (September 2023). Er nehme in Kauf, „dass sich NGT-Pflanzen, die sich später als schädlich für Mensch oder Umwelt erweisen, derart in der natürlichen Umwelt ausbreiten, dass sie später nicht mehr rückholbar sind.“ Was die Kommission wolle , „ist blind für Umwelt- Gesundheitsrisiken, die von gentechnisch veränderten Organismen ausgehen können“ - unabhängig davon, ob dabei „alte oder neue Gentechnik“ genutzt wurde“, so der grüne Bundestagsabgeordnete Harald Ebner. „Der Gentechnik-Vorschlag der EU-Kommission“, pflichtet der Verbraucherzentrale Bundesverband bei, „wirft das Vorsorgeprinzip über Bord“.
Doch sind die Gen-Schere CRISPR/Cas und ähnliche Verfahren wirklich so neu und ihre Wirkungsweise so wenig verstanden, dass „sich mögliche Risiken und Folgen überhaupt nicht abschätzen lassen“, wie Greenpeace meint? Sind mit den neuen Verfahren wissenschaftlich plausible Risiken verbunden? Oder argumentieren die Kritiker mit eher spekulativen, rein hypothetischen Risiken jenseits der Schwelle der praktischen Vernunft“ (Leopoldina)? Missbrauchen sie das Vorsorgeprinzip als politisch opportunes Stopp-Schild, um die ungeliebte Gentechnik auf Dauer in Europa zu verhindern?
Gezielte Punktmutation im Labor und zufällige Mutationen in der Natur
Wenn eine Pflanze editiert und so ein einzelner DNA-Baustein verändert wird, passiert auf molekularer Ebene fast dasselbe wie bei einer natürlichen Mutation – mit dem einzigen Unterschied: Sie ereignet sich nicht irgendwo im riesigen Genom einer Pflanze, sondern an einer vorgegebenen Stelle, von der man aus der Forschung weiß, dass sie für eine bestimmte Eigenschaft verantwortlich ist, etwa für die Widerstandsfähigkeit gegenüber einer Pilzkrankheit. Genau dort wird der DNA-Strang durchtrennt und anschließend vom zelleigenen Reparatursystem wieder zusammengefügt. Dabei können einzelne DNA-Bausteine ausgetauscht werden oder ein vorhandenes Gen „abgeschaltet“ werden - wie bei einer zufälligen Mutation in der Natur.
Mutationen sind überall. Bei jeder neuen Generation einer Pflanze kommt es grob geschätzt zu einer Mutation auf jeweils 150 Millionen DNA-„Buchstaben“ ihres Erbguts (150.000 Kilobasenpaare, kbp). Bezogen auf die jeweilige Genomgröße sind das bei Kartoffeln 6, bei Weizen mit seinem sehr großen Genom 120 zufällige, im einzelnen nicht bekannte Mutationen.
Mutationen ereignen sich ständig und überall, bei jeder Zellteilung und jeder Vermehrung. Ohne sie gäbe es keine Evolution. Jede Mutation bedeutet eine Veränderung im Erbgut. Wo sie geschieht und was sie bewirkt, ist allein vom Zufall abhängig. Züchter haben gelernt, mit Mutationen umzugehen und sie – anfangs mehr intuitiv - zu nutzen, um Pflanzen mit interessanten Merkmalen zu erhalten.
Mit nur einer einzelnen Mutation an einem bestimmten Ort sind Eingriffe mit der Gen-Schere um einen Quantensprung präziser. Dennoch ist es durchaus möglich, dass der Erbgut-Strang einer Pflanze nicht nur am gewünschten Ziel, sondern auch an anderen, im Einzelnen unbekannten Stellen durchtrennt wird. Solche unbeabsichtigten Fehlschnitte werden als Off-target-Effekte bezeichnet. Wo genau sich diese ereignen, wie sich dadurch Eigenschaften verändern und welche negativen Folgen das haben könnte, weiß man im Einzelnen nicht.
Doch sind Off-target-Effekte wirklich so zahlreich und unkontrollierbar wie es die kritischen Einwände nahelegen? Sind dadurch bedingte Risiken für Mensch, Tier und Umwelt so gravierend, dass weitreichende Einschränkungen der neuen Züchtungsverfahren gerechtfertigt sind?
Wenn CRISPR das Ziel verfehlt. Das Risiko von Off-target-Effekten
Eine Arbeitsgruppe am Julius-Kühn-Institut (Institut für die Sicherheit biotechnologischer Verfahren bei Pflanzen, Quedlinburg) hat in Form eines systematischen Reviews mehr als tausend Publikationen zu Genome Editing-Anwendungen bei Pflanzen ausgewertet, überwiegend aus der Grundlagenforschung (2019). 252 dieser Publikationen enthielten Angaben zu möglichen Off-target-Effekten, bei den meisten (ca. 90 Prozent) wurde das CRISPR-Verfahren eingesetzt.
Die Wahrscheinlichkeit von Off-target-Effekten hängt vor allem davon ab, ob die molekulare Sonde – bei CRISPR die Guide-RNA (siehe Grafik oben links) – nicht nur an der vorgesehenen Zielsequenz andockt, sondern auch an weiteren ähnlichen Stellen im Genom. Wenn es solche geben sollte, spürt die Sonde diese auf und die Gen-Schere (Cas-Protein) durchtrennt den DNA-Strang auch dort. Ungewollt können sich dadurch Eigenschaften der Pflanze verändern.
Mit Hilfe geeigneter Bioinformatik-Programme lassen sich jene Sequenzen im Pflanzen-Erbgut identifizieren, bei denen aufgrund der Ähnlichkeit mit der Zielsequenz das Risiko von Fehlschnitten – also unbeabsichtigte Mutationen – groß ist. Genau diese empfindlichen Stellen kann man genauer untersuchen, ob es tatsächlich dazu gekommen ist (biased detection). In etwa drei Prozent der möglichen Off-target-Bereiche war das der Fall, so die Auswertung der JKI-Arbeitsgruppe.
Einige der Forschungsprojekte untersuchten nicht nur die potenziellen Off-target-Zonen, sondern das gesamte Genom der editierten Pflanze (unbiased detection). In keinem Fall konnten unbeabsichtigte Veränderungen gefunden werden. Allerdings war die Anzahl dieser Publikationen zu gering, um abgesicherte Ergebnisse daraus abzuleiten.
Inzwischen ist es Stand der Wissenschaft: Je länger die Zielsequenz ist, die von der CRISPR-Sonde angesteuert wird, um so unwahrscheinlicher ist es, dass genau diese DNA-Abfolge irgendwo im Genom der jeweiligen Pflanze noch einmal vorkommt – und um so unwahrscheinlicher sind Off-target-Effekte. Durch einen geeigneten Zuschnitt der jeweiligen Zielsequenz – und die entsprechende Konstruktion der Sonde, die sie im Genom aufspürt – lassen sich Fehlschnitte drastisch reduzieren.
„Jenseits der Schwelle praktischer Vernunft“
Doch anders als mögliche Fehler bei der alten Gentechnik sind Off-target-Effekte beim Genome Editing nichts anderes als weitere Mutationen – und die sind in der herkömmlichen Pflanzenzüchtung nichts Ungewöhnliches. Im Gegenteil: Von einer Generation zur nächsten kommt auf 150 Millionen Basenpaare (DNA-Bausteine) irgendwo ein „Fehler“ im Erbgut. Bei Kartoffeln sind es etwa sechs solcher spontanen zufälligen Veränderungen, bei Weizen mit seinem riesigen Genom bis zu 200, allein bei einer Pflanze. In einem ganzen Feld sind es Millionen.
In der Mutationszüchtung (Mutagenese), seit vielen Jahren bei verschiedenen Kulturarten eingesetzt, werden diese natürlichen Mutationsraten durch Chemikalien und Bestrahlung etwa um das 700-fache erhöht.
Im Einzelnen sind solche „natürlichen“ oder durch künstliche Reize getriggerte Mutationen nicht bekannt – weder ihre Orte im Genom, noch ihre Anzahl und die Wirkungen, die sie hervorrufen. Wenn sie sich nicht im Erscheinungsbild (Phänotyp) niederschlagen und auch nicht messbar sind, bleiben sie unbeachtet. Unzählige Mutationen, die für die Pflanze keinen erkennbaren Nachteil bringen, laufen in der Züchtung einfach mit.
Das Vorsorgeprinzip gilt nicht im Restrisikobereich, also in demjenigen Bereich, in dem Ungewissheiten jenseits der „Schwelle praktischer Vernunft“ liegen, weil Risiken nach dem Stand von Wissenschaft und Technik praktisch ausgeschlossen erscheinen.
Leopoldina Nationale Akademie der Wissenschaft; Stellungnahme zu genom-editierten Pflanzen (2019), S. 31
Ein Problem ist das bisher nicht. Auch wenn manchmal Eigenschaften – etwa Geschmack – im Züchtungsverlauf verloren gehen oder es nicht ausgeschlossen ist, dass infolge spontaner Mutationen eine Pflanze plötzlich Allergene bildet – niemand fordert, das Vorsorgeprinzip auch bei konventionell gezüchteten Pflanzen anzuwenden oder vollständige Gewissheit über alle Mutationen und die dadurch bewirkten DNA-Änderungen zu verlangen, bevor sie ausgesät werden dürfen.
Beim Genome Editing sollen dagegen andere Maßstäbe gelten. Zufällige Mutationen, über die sich bei konventioneller Züchtung niemand Gedanken macht, heißen nun plötzlich Off-target-Effekte und stehen unter Verdacht ernster Sicherheitsrisiken. Dabei ist der molekularbiologische Mechanismus – Schnitt im DNA-Strang und anschließende Reparatur durch die Zelle – jeweils derselbe. Der Unterschied: Als Off-Target-Ereignisse sind Mutationen beim Genome Editing selten und weitgehend vermeidbar, ungerichtete Mutationen bei der Züchtung jedoch nicht.
Für die Wissenschaft ist es weitgehend Konsens: Genom-editierte Pflanzen ohne zusätzlich eingeführte Fremd-Gene, die unter natürlichen Bedingungen auch „von selbst“ entstehen könnten, sind mit der alten Gentechnik nicht vergleichbar. Strikte Regulierungen bis hin zu Verboten sind unbegründet – und mit Blick auf das Vorsorgeprinzip auch nicht notwendig. Dessen Anwendung „darf nicht an spekulative Risiken anknüpfen“, so die Leopoldina Nationale Akademie der Wissenschaften in ihrer viel beachteten Stellungnahme „Wege zu einer wissenschaftlich begründeten, differenzierten Regulierung genomeditierter Pflanzen in der EU“. „Vielmehr ist das Vorsorgeprinzip wissenschaftsbasiert anzuwenden. […] Vorsorgemaßnahmen lassen sich nicht auf rein spekulative Erwägungen stützen.“
Vielleicht – und das legen die Empfehlungen der Leopoldina nahe – wäre es im Sinne einer vorsorgenden Klimapolitik sogar geboten, die neuen Genome Editing-Verfahren nicht zu blockieren, sondern ihre Potenziale für eine nachhaltige, weniger Ressourcen und Flächen verbrauchende Landwirtschaft zu nutzen.
Diskussion / Kommentare
 Kommentare werden geladen…
Kommentare werden geladen…
Themen

Genome Editing und Vorsorgeprinzip. Ein Thema für die Ethik. Wie verhalten sich Vorsorge und Innovation zueinander? Als Gegensätze oder aber als zwei Seiten derselben Medaille, deren „Währung“ die Zukunftsvorsorge ist?
Im Web
- Dominik Modrzejewski et al.; What is the available evidence for the range of applications of genome-editing as a new tool for plant trait modification and the potential occurrence of associated off-target effects: a systematic map; Environmental Evidence volume 8, Article number: 27 (2019)
- Nationale Akademie der Wissenschaften Leopoldina, Union der deutschen Akademien der Wissenschaften und Deutsche Forschungsgemeinschaft, Wege zu einer wissenschaftlich begründeten, differenzierten Regulierung genomeditierter Pflanzen in der EU (2019)
- Stephan Schleissing, Genome Editing als Thema für die Ethik (pflanzen-forschung-ethik)
- Mario Berkefeld, Stephan Schleissing; Das Vorsorgeprinzip - oder: Wie viel Vorsorge braucht verantwortbare Innovation? (pflanzen-forschung-ethik)
- Mitteilung der Kommission über die Anwendbarkeit des Vorsorgeprinzips; KOM (2000) 1 endgültig
- Karl Bär und Harald Ebner zur Veröffentlichung eines Rechtsgutachtens zum Vorschlag der EU-Kommission zur Deregulierung neuer Gentechnikverfahren; Bündnis 90 / Die Grünen im Bundestag 22.09.2023
- Gentechnik-Vorschlag der EU-Kommission wirft Vorsorgeprinzip über Bord, Verbraucherzentrale Bundesverband, 27.09.2023
- SPD-Bundestagsfraktion, Neue Gentechniken: Vorsorgeprinzip und Transparenz sind unverhandelbar, 29.04.2021
- Greenpeace, Gentechnik: Riskante Manipulation der Natur; Hintergrund 18.06.2021