
Gene Drives gegen Malaria-Mücken und andere Schädlinge
von Juliette Irmer
Gene Drives sind eine neue Methode der Gentechnik, mit der die Ausbreitung von Infektionskrankheiten, Pflanzenschädlingen und invasiven Arten gezielt kontrolliert werden könnte. Das funktioniert, indem man die Vererbung einer gewollten genetischen Veränderung, etwa Unfruchtbarkeit, beschleunigt, so dass diese sich rasch in einer Population ausbreitet. Die Technologie hat in den vergangenen Jahren große Fortschritte gemacht und könnte bald so ausgereift sein, dass sie für Freilandtests infrage kommt. Ob es so weit kommt, ist jedoch offen, denn Gene Drives werfen viele Fragen in punkto Bioethik und Umweltsicherheit auf.
Wissenschaftler hatten schon in den 1960er Jahren die Idee, Gene Drives für die Kontrolle krankheitsübertragender Mücken zu nutzen. Sie hatten beobachtet, dass der Mechanismus natürlicherweise in Hefen, Mücken und Nagern vorkommt. Der technische Durchbruch gelang aber erst nach der Entdeckung der CRISPR/Cas-Methode 2012.
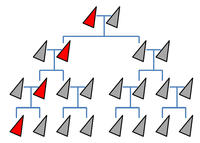
Normale Vererbung ohne Gene Drive: Eine bestimmtes Merkmal - etwa eine gentechnisch erzeugte Sterilität (rot) - wird nur an die Hälfte der Nachkommen weitergegeben. Wenn es keinen Überlebensvorteil vermittelt, wird sich das neue Merkmal in der Population nicht etablieren.
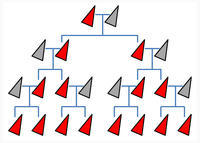
Mit Gene Drive wird dieses Merkmal an alle Nachkommen weitervererbt und breitet sich sehr schnell in der gesamten Population aus.
Großes Foto oben: iStock/Jayprrasad Naik
Mithilfe eines Gene Drives wird die Vererbung einer bestimmten genetischen Veränderung beschleunigt, die Mendelschen Regeln werden dabei umgangen. Die besagen, dass in jeder Generation durchschnittlich 50 Prozent der Nachkommen eine bestimmte Genvariante erben. Per Gene Drive sind es im Idealfall 100 Prozent, so dass nach wenigen Generationen alle Individuen einer Population die gewünschte Veränderung in ihrem Erbgut aufweisen (Infokasten links). Das gelingt, weil mithilfe der Gen-Schere CRISPR/Cas die gewünschte Genveränderung in beide Kopien eines Chromosoms eingebracht wird (Info rechts) und auch die Gen-Schere selbst mitvererbt wird.
Gene Drives haben das Potential die Schädlingsbekämpfung zu verbessern: Statt ökologischen Problemen mit unspezifischen Maßnahmen wie Insektiziden und Giftködern zu begegnen, die auch etliche andere Tierarten schädigen, bieten Gene Drives die Möglichkeit gezielt nur einzelne Arten zu dezimieren.
WHO: Gene Drives weiter erforschen
Ganz oben auf der Liste der Kandidaten stehen mehrere Mückenarten. Sie übertragen Krankheiten wie Malaria, Gelbfieber und Dengue, die jedes Jahr zehntausende Menschen das Leben kosten. An Malaria allein starben 2021 etwa 619.000 Menschen, häufig trifft es Kinder unter fünf Jahren. Ein neuer Impfstoff, Mosquirix, sorgt für Hoffnung, aber mit vier notwendigen Immunisierungen und einer nur mäßigen Wirkung braucht es weitere Schutzmaßnahmen, zumal Resistenzen gegen bislang erfolgreiche Medikamente und Insektizide zunehmen. So spricht sich auch die WHO für die Erforschung von Gene Drives aus und hat 2021 entsprechende Leitlinien veröffentlicht.
Gene Drives könnten auch in der Landwirtschaft und im Artenschutz Anwendung finden, indem sie etwa invasive Arten zurückdrängen. In Kalifornien haben Wissenschaftler ein Gene-Drive-System entwickelt, mit dem sich die bei Obstbauern gefürchtete und ursprünglich aus Südostasien stammende Kirschessigfliege bekämpfen ließe, die auch hierzulande große Schäden anrichtet. Geforscht wird auch an Gene Drives, die Resistenzen gegen bestimmte Insektizide in Schädlingen wieder aufheben.
Im Naturschutz wird vor allem der Einsatz von Gene Drives auf Inseln diskutiert. Auf diese Weise könnten etwa invasive Nagetiere wie Ratten und Mäuse gezielt eliminiert werden, so dass sich die einheimische Tierwelt wieder erholen kann.
Mittlerweile existiert eine Vielzahl verschiedener Gene-Drive-Systeme, grob kann man folgende Ansätze unterscheiden:
- Suppression Drive: Das genetische Äquivalent zum Insektizid mit dem Ziel, eine Population zu reduzieren oder gar auszulöschen.
- Modification Drive: Die Tiere bleiben am Leben. Ihnen wird per Gene Drive etwa die Fähigkeit genommen, Krankheitserreger zu übertragen.
Bislang wurden Gene Drives im Labor oder in Biosicherheits-Insektarien in Hefen, Fliegen, Mücken und Mäusen getestet. Nicht jede Art ist Gene Drive-tauglich. In Frage kommen nur Organismen, die sich sexuell fortpflanzen und die eine möglichst kurze Generationszeit aufweisen, denn trotz beschleunigter Vererbung braucht es mehrere Generationen, bis eine gewünschte Veränderung eine Population vollständig durchdringt. Weltweit hat noch keine Regulierungsbehörde grünes Licht für die Freisetzung eines Gene Drives gegeben.
Malaria übertragende Mücken: Populationen brechen nach wenigen Generationen zusammen
Am weitesten fortgeschritten ist die Forschung an der Mücke Anopheles gambiae, eine der Hauptüberträgerarten von Malaria. Eine Forschergruppe um Andrea Crisanti, einem Pionier der Gene Drive-Forschung und Mitglied von Target Malaria, einem Konsortium, dass sich dem Kampf gegen Malaria verschrieben hat, hat einen Gene Drive entwickelt, der das Gen doublesex verändert: Die Weibchen werden dadurch unfruchtbar und legen keine Eier. Die Forschergruppe konnte wiederholt zeigen, dass ihre Mückenpopulationen nach mehreren Generationen zusammenbrechen. Zuletzt gelang ihnen das auch in knapp fünf Kubikmeter großen Biosicherheits-Insektarien.
Auch wenn der Zusammenbruch der Population erklärtes Ziel eines suppression drives ist – selbstverständlich ist es nicht. Wie bei anderen Formen der Schädlingsbekämpfung fördern suppression drives die Entwicklung von Resistenzen: Der Gene Drive verliert damit seine Wirkung und Mücken oder Pflanzenschädlinge vermehren sich wieder.
Die Funktionsweise der Gen-Schere CRISPR/Cas kann zur Entstehung von Resistenzen beitragen: Die Gen-Schere schneidet das Erbgut an einer gewünschten Stelle, die Reparatur übernimmt aber die Zelle. Im Idealfall kommt es zur so genannten homologen Reparatur (homology directed repair, HDR) bei der die Zelle das Chromosom mit dem Gene Drive als Vorlage nutzt und diese Information in das neue Chromosom kopiert.
Allerdings existiert noch ein zweiter Reparaturmechanismus, bei dem nur die losen DNA-Enden miteinander verknüpft werden (non-homologous end joining). Dabei können auch zusätzliche Basen eingefügt oder weggelassen werden. In diesem Fall erkennt die Gen-Schere ihre Schnittstelle im nächsten Fortpflanzungszyklus nicht mehr, so dass kein Gene Drive installiert wird.
Crisantis Gene Drive ist erfolgreich, weil das Team mit doublesex ein hoch konserviertes Gen nutzt, also eines, das in der Entwicklung von Mücken eine so große Rolle spielt, dass Veränderungen der Basenabfolge der DNA nicht toleriert werden. Wird der Schnitt der Gen-Schere fehlerhaft repariert, stirbt die Mücke. Folglich überleben nur jene Mücken mit korrekt kopiertem Gene Drive.
Zumindest in der Theorie ließe sich mit einem solchen suppression drive eine freilebende Art gezielt auslöschen. Ein Szenario, das es bislang so noch nie gab – und das in der Öffentlichkeit Kritik und viele Fragen hervorruft – was passiert zum Beispiel im Ökosystem, wenn eine Art ausgelöscht wird? (Eine wichtige Frage, die man sich nicht nur im Zusammenhang mit Gentechnik stellen sollte).
Modification drives funktionieren subtiler: Beispielsweise haben Wissenschaftler Mücken so verändert, dass sie einen Antikörper exprimieren, der die Insekten gegen die Erreger von Denguefieber schützt, die sie dann auch nicht auf Menschen übertragen können. Andere Forschergruppen wollen Malaria-Mücken mit einer bestimmten Genvariante ausstatten, die dafür sorgt, dass die Malariaerreger sich im Mückendarm nicht vermehren können.
Nicht nur das Potential, auch der Widerstand gegen diese Technologie ist groß und es wurden wiederholt Forderungen nach einem weltweit gültigen Moratorium laut, das die Freisetzung von Gene-Drive-Organismen untersagen soll. Ein solches Moratorium kam bislang nie zustande, auch weil die afrikanischen Staaten, die am stärksten unter Malaria leiden, nicht einwilligten. Stattdessen wurde während der Weltnaturkonferenz im Dezember 2022 beschlossen, dass eine Expertengruppe zusätzliche Leitlinien für die Risikobewertung und das Management von Gene-Drive-Organismen erarbeiten soll.
Kevin Esvelt, ein renommierter Gene Drive-Experte vom Massachusetts Institute of Technology (MIT) in Cambridge, setzt sich schon viele Jahre für eine maximale Transparenz bei der Gene-Drive-Forschung ein: „Wir plädieren grundsätzlich für Transparenz, auch in frühen Forschungsphasen. Wir müssen sicherstellen, dass eine Anwendung so sicher und effektiv wie möglich entwickelt wird und Menschen, die davon betroffen wären, eine Stimme haben.“
Derweil arbeiten Wissenschaftler daran die Technologie weiter zu verfeinern: Mittlerweile existieren selbstlimitierende Systeme, die von vorneherein räumlich und zeitlich beschränkt sind, es gibt die Möglichkeit nachzusteuern, wenn Resistenzen auftreten, sowie RNA-basierte Rückholsysteme, um einen Gene Drive zu inaktivieren (e-CHACR) oder vollständig zu löschen (ERACR). Cristantis Team forscht auch an einem aus Phagen (spezielle Viren, die Bakterien befallen) stammenden Anti-CRISPR-Protein, das in der Lage ist, CRISPR-basierte Gene Drives in der Malaria-Mücke Anopheles gambiae zu inaktivieren.
Um zu erfahren, ob sich Gene Drive-Organismen in der Natur überhaupt behaupten könnten, wo die Konkurrenz durch freilebende Artgenossen möglicherweise höher ist als im Labor, wären zunächst Freilandversuche in begrenzten Umgebungen wie etwa isolierten Inseln notwendig. Technisch könnten die Voraussetzungen dafür bald erfüllt sein. Demgegenüber stehen weitreichende ethische und auch regulatorische Fragen und ein vermutlich langwieriger Abwägungsprozess zwischen den möglichen Risiken und den zu erwartenden Vorteilen von Gene Drives.
Gene Drive ist NICHT Genome-Editing
Gene Drive und Genome Editing nutzen oftmals das gleiche Werkzeug: CRISPR/Cas. Dennoch können die beiden Methoden nicht gleichgesetzt werden: Bei der Genome-Editierung wird eine genetische Veränderung ins Erbgut eingeführt, die den Mendelschen Regeln unterliegt. Ein Gene Drive umgeht die Vererbungsregeln und vererbt sich autonom an alle Nachkommen.
Regulierung von Gene Drives
Gene Drive-Systeme unterliegen grundsätzlich den nationalen und internationalen Gentechnik-Gesetzgebungen. Denn alle synthetischen Gene Drive-Organismen (GDO) sind automatisch auch gentechnisch veränderte Organismen (GVO), da sie mindestens ein Fremdgen enthalten, etwa das Enzym Cas9. Die Produkte der noch jungen Technologie sind somit bereits reguliert. Was nicht bedeutet, dass das Regelwerk nicht aufgrund der Gene Drive-Besonderheiten angepasst werden muss.
Diskussion / Kommentare
 Kommentare werden geladen…
Kommentare werden geladen…
Themen
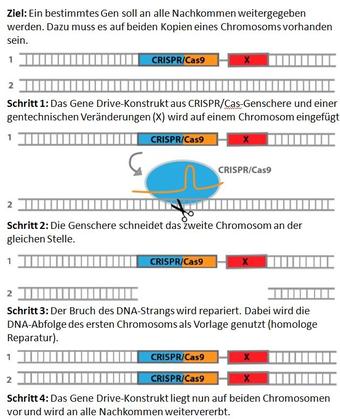
Grafik: Forum Genforschung, Akademie der Naturwissenschaften Schweiz (SCNAT)
Gene Drives könnten eines Tages eingesetzt werden, um Malaria-Mücken oder Landwirtschaftsschädlinge zu bekämpfen. Wie funktioniert diese neue Technik? Wie groß ist ihr Potenzial und ihr Risiko? Und welche ethischen Fragen stellen sich? (Sciences Switzerland)
Im Web
- Ethan Bier, Gene drives gaining speed; Nature Reviews Genetics volume 23, pages5–22 (2022)
- Tina Hesman Saey, Who decides whether to use gene drives against malaria-carrying mosquitoes? Science News Hune 3, 2022
- WHO issues new guidance for research on genetically modified mosquitoes to fight malaria and other vector-borne diseases; 19 May 2021
- Andrew Hammond et al, Gene-drive suppression of mosquito populations in large cages as a bridge between lab and field; Nature Communications volume 12, (2021)
- Bhagyashree Kaduskar et al, Reversing insecticide resistance with allelic-drive in Drosophila melanogaster; Nature Communications volume 13, (2022)
- Xiang-Ru Shannon Xu et al, Active Genetic Neutralizing Elements for Halting or Deleting Gene Drives; Molecular Cell, Volume 80, Issue 2, 15 October 2020
- Chrysanthi Taxiarchi et al, A genetically encoded anti-CRISPR protein constrains gene drive spread and prevents population suppression; Nature Communications, 25 Jun 2021
- Target Malaria scientists create a genetically modified mosquito to produce male-only progeny that effectively reduces the population of malaria mosquitoes in the lab at Imperial College (11.05.2020)
- Austin Burt, Andrea Crisanti (2018) Gene Drive: Evolved and Synthetic; ACS Chem. Biol. 13
- Kyros Kyrou et al. (2018) A CRISPR–Cas9 gene drive targeting doublesex causes complete population suppression in caged Anopheles gambiae mosquitoes; Nature Biotechnology 36
- Gene Drive, Naturwissenschaften Schweiz / Forum Genforschung





