CRISPR/Cas, TALEN, Zinkfinger, ODM: Wie die Genome Editing-Verfahren funktionieren
Neue molekularbiologische Verfahren - allen voran die Gen-Schere CRISPR/Cas - sorgen in der Pflanzenforschung weltweit für Furore. Sie sind weitaus genauer, präziser und effizienter als die klassische Gentechnik. Und sie versprechen Lösungen, wo die herkömmliche Züchtung oft nicht weiter kommt. Alle Verfahren funktionieren ähnlich: An einer vorgegebenen Stelle im Erbgut führen sie gezielt einzelne Mutationen herbei und verändern dort einzelne DNA-Bausteine. Damit können neue oder verbesserte Eigenschaften editiert werden, ohne „fremde“ Gene einfügen zu müssen.
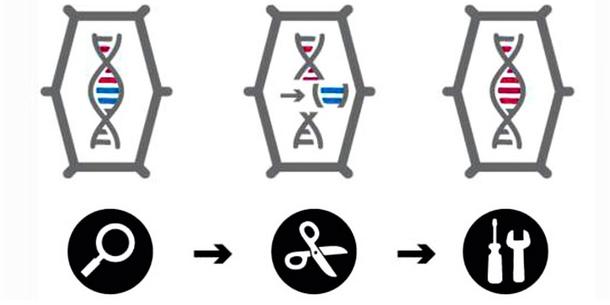
Die verschiedenen Verfahren werden unter dem Begriff Genome Editing (oder Gene Editing) zusammengefasst, manchmal auch als „Gen-Schere“ oder „Gen-Chirurgie“ bezeichnet. Inzwischen ist auch der Oberbegriff Neue genomische Techniken (NGT) gebräuchlich. Im Kern bestehen die Genome Editing-Verfahren aus drei Schritten.
(1) Suchen und finden: Zunächst muss im riesigen Genom einer Pflanze, das oft aus Milliarden Basenpaaren (DNA-Bausteinen) besteht, genau die Stelle gefunden und angesteuert werden, bei der eine Änderung durchgeführt werden soll. Dazu werden im Labor „Sonden“ konstruiert, die genau zu der jeweiligen Ziel-Sequenz passen, so dass sie diese finden können. Das Funktionsprinzip dieser Sonden ist bei den einzelnen Genome Editing-Verfahren unterschiedlich.
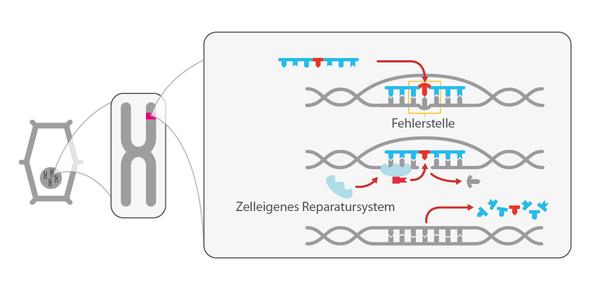
(2) Schneiden: Genau an der jeweiligen Zielsequenz – und nur da – wird der DNA-Strang mit einer molekularen „Schere“ – meist ein Protein – geschnitten. In der Regel werden beide Elemente – „Sonde“ und „Schere“ – in Form ihrer DNA in die Pflanzenzelle eingeführt.
(3) Reparieren: Der an der jeweiligen Zielstelle herbeigeführte DNA-Doppelstrangbruch wird nun durch zelleigene Reparaturmechanismen wieder „geflickt“ – genau wie bei jeder natürlichen Mutation. Im Regelfall gehen dabei einzelne DNA-Bausteine verloren oder sie werden „falsch“ zusammengesetzt (nicht-homologe Rekombination, siehe Grafiken). Die Folge: Das betreffende Gen kann nicht mehr richtig abgelesen werden, das dazu gehörende Genprodukt (Protein) wird nicht mehr gebildet. Möglich ist auch, bei der Reparatur des Bruchs einzelne DNA-Bauteile auszutauschen oder sogar Gensequenzen einzufügen (homologe Rekombination).
Diese Reparatur und die dabei möglichen Veränderungen der DNA sind bei allen Genome Editing-Verfahren ähnlich. Unterschiedlich ist, wie die Zielsequenz gefunden und der Doppelstrangbruch durchgeführt wird.
Genom-editierte Pflanzen, die für eine landwirtschaftliche Nutzung vorgesehen sind, sind „transgen-frei“: Nur solche Nachkommen werden etwa zu Saatgut vermehrt, bei denen die zuvor eingeführte DNA für die Editier-Werkzeuge infolge von Rückkreuzungen nicht mehr vorhanden ist. Inzwischen ist es auch möglich, die benötigten Elemente direkt DNA-frei in die Pflanzenzellen einzuschleusen.
Wenn mit einem der Genome Editing-Verfahren ein bestimmtes Pflanzenmerkmal geändert oder optimiert werden soll, müssen die zu editierenden Gene und ihre Funktion vollständig bekannt sein. Das erfordert viel Genomforschung und ein genaues Wissen über die molekularbiologischen Prozesse in der Pflanzenzelle.
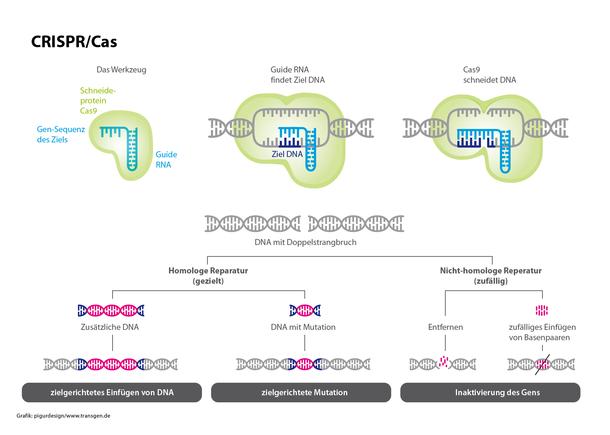
Das CRISPR/Cas-System ist das mit Abstand am häufigsten genutzte Genome Editing-Verfahren in der Pflanzenforschung. Es besteht – etwas vereinfacht – aus einer synthetisch zusammengesetzten RNA-Abfolge, die genau der zu verändernden DNA-Zielsequenz entspricht. Diese guide RNA findet das Ziel, dockt dort an und der daran gekoppelten CRISPR-Komplex mit dem Schneideprotein Cas9 wird aktiv.
Ursprünglich stammt das System aus Bakterien und ist eine Art Immunsystem, mit dem sich Bakterien gegen Angriffe von Viren wehren.
Stand. Bisher wird CRISPR/Cas vor allem in der Grundlagenforschung eingesetzt, um schnell und einfach einzelne Gene abzuschalten. Daraus lassen sich Erkenntnisse über die Funktionen einzelner Gene oder deren Wechselwirkungen gewinnen. Verglichen mit anderen Genome Editing-Verfahren hat CRISPR/Cas viele Vorteile: Die guide RNA lässt sich schnell und einfach „programmieren“. Dadurch ist die CRISPR/Cas-Methode in der Regel deutlich kostengünstiger.
Eine europäische Datenbank (EU-sage) listet knapp 600 publizierte Forschungsprojekte mit zahlreichen Pflanzenarten auf, bei denen CRISPR/Cas eingesetzt wurde (Januar 2023). Einige CRISPR-editierte Pflanzen werden bereits im Freiland getestet. Erste mit CRISPR entwickelte Pflanzen sind in Japan und den USA schon auf dem Markt, weitere stehen kurz vor der Markteinführung.
Das CRISPR/Cas-System wurde seit seiner Entdeckung kontinuierlich weiterentwickelt. Inzwischen stehen eine Reihe von Varianten mit noch größerer Zielgenauigkeit und einem breiteren Anwendungsspektrum zur Verfügung, etwa Base Editing, Prime Editing (siehe unten), Cas13, Cpf1). Mit den neuen CRISPR-Systemen können Eingriffe auf verschiedenen Ebenen im Genom vorgenommen werden. So ist es beispielsweise möglich, zum Epigenom gehörende Elemente zu beeinflussen, Chromosomen-strukturen zu verändern oder erst nach der Transkription einzugreifen.
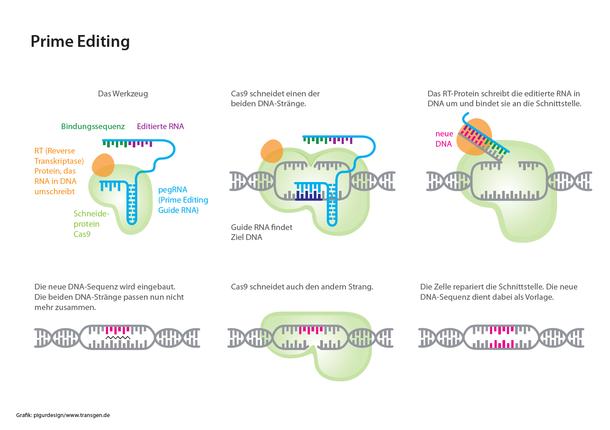
Als Prime Editing wird eine neue, verbesserte Variante des CRISPR/Cas-Systems bezeichnet, welche die DNA nicht nur gezielt schneidet, sondern auch effizienter reparieren kann. Das Risiko für Fehler ist deutlich geringer als bei den übrigen Genome Editing-Verfahren.
Ähnlich wie beim CRISPR/Cas-System wird zunächst zielgenau eine Stelle auf der DNA angesteuert. Dort wird allerdings nicht der DNA-Doppelstrang geschnitten, sondern nur einer der beiden Stränge. Dadurch wird das Risiko für Fehler deutlich gesenkt. Als Sonde für die jeweilige Zielsequenz dient wie bei CRISPR/Cas eine passende RNA, die gleichzeitig auch die Information für die DNA-Veränderung mitbringt. Ein zusätzliches Enzym des Prime-Systems (Reverse Transkriptase) fügt diese Information in die Schnittstelle ein. Da die beiden DNA-Stränge an dieser Stelle nun nicht mehr zueinander passen, schneidet das Schneideprotein Cas auch den nicht editierten Strang. Der Schnitt wird automatisch von der Zelle anhand des zuvor editierten DNA-Strangs repariert.
Stand. Prime Editing verspricht eine höhere Effizienz bei der Einführung gezielter DNA-Veränderungen. Die Technik könnte somit ein wertvolles Werkzeug sowohl in der Medizin als auch in der Pflanzenzüchtung werden. Bisher befindet sich die Methode noch in einem frühen Stadium der Grundlagenforschung. Forschungsprojekte laufen zum Beispiel an Reis und Weizen.
Weitere CRISPR-Variante: Base Editing
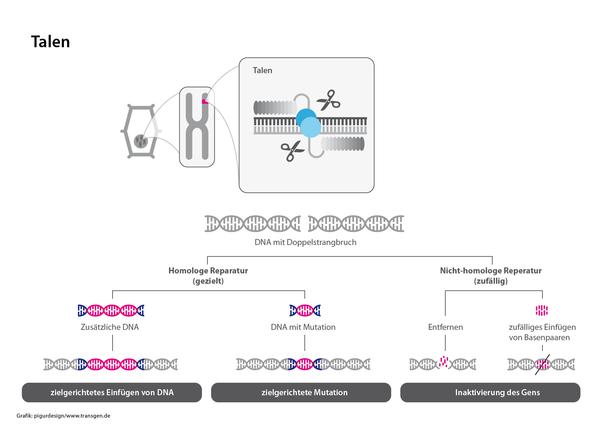
TALEN (Transcription activator-like effector nuclease) und Zinkfinger-Nukleasen sind Genome Editing-Verfahren, die vor CRISPR/Cas entdeckt und entwickelt wurden. Das Grundprinzip ist ähnlich, jedoch ist die Konstruktion der funktionalen Elemente – Sonde und Schneidewerkzeug – deutlich aufwändiger und komplexer als bei CRISPR/Cas.
Bei TALEN werden sogenannte TAL-Effektorproteine synthetisch so hergestellt, dass sie als Sonde ganz spezifisch die zu editierende Zielsequenz erkennen und dort an die DNA binden. Die TAL-Effektoren werden mit einer Nuklease (DNA schneidendes Enzym) gekoppelt, welche den DNA-Doppelstrang schneiden. Dieser Bruch wird dann durch zelluläre Mechanismen repariert. Dabei können Gene eingefügt, entfernt oder ausgeschaltet werden.
Zinkfinger-Nukleasen bestehen aus einem spezifischen konstruierten Zinkfinger-Protein, dessen Form (fingerähnliche Ausstülpung) genau zur Zielsequenz passt und dort andockt. Anschließend durchtrennen Nukleasen die DNA und es entsteht ein Doppelstrangbruch.
Stand. In den USA ist eine mit TALEN gezüchtete Sojabohne auf dem Markt, die weniger gesättigte Fettsäuren und dafür mehr Ölsäure enthält. Weitere Pflanzen befinden sich in den USA kurz vor der Markteinführung. Zinkfinger-Nukleasen werden in der Züchtung, etwa bei Raps, Soja, Mais, Tomate, Tabak eingesetzt.
Auch mit der oligonukleotid gerichtete Mutagenese (ODM) werden gezielt Mutationen im Genom hervorgerufen. Im Gegensatz zu den meisten anderen Genome Editing-Methoden erfolgt dabei kein Schnitt des Doppelstrangs. Die Methode entspricht dem natürlichen Mechanismus der Oligonukleotid-gerichteten Genreparatur, bei der in den Zellen kurze Nukleotidsequenzen als Vorlagen dienen, um Kopierfehler auf der DNA zu erkennen und zu reparieren. Bei der ODM werden solche Sequenzen synthetisch hergestellt (Oligonukleotide) und in die Zelle eingeführt. Diese sind nahezu vollständig komplementär zur Ziel-DNA der Zelle, nur einzelne oder einige wenige Basen wurden bewusst ausgetauscht. Die Oligonukleotide dienen als Reparaturvorlage, um die Veränderungen mit Hilfe der zelleigenen Reparatursysteme auf die Zell-DNA zu übertragen. Mit ODM können Gene gezielt ausschaltet, aktiviert oder verändert werden.
Stand. ODM wird in der Züchtung eingesetzt, etwa bei Raps, Mais, Weizen, Reis oder Banane. Es können ähnliche Merkmale (Resistenzen gegen Schädlinge und Krankheiten, Herbizidtoleranz, Toleranz gegen abiotischen Stress, veränderte Stärke- und Fettsäurezusammensetzung) in Pflanzen eingebracht werden wie mit gentechnischen Verfahren. Erste mit ODM gezüchtete Sorten sind in Nordamerika auf dem Markt, zum Beispiel herbizidtoleranter Raps.
Nachweis: Kann man eine editierte Pflanze von einer natürlich vorkommenden unterscheiden?
Mit den heutigen molekularbiologischen Analyseverfahren ist es inzwischen möglich, genetische Unterschiede zwischen einzelnen individuellen Organismen – etwa Pflanzen – relativ einfach und zuverlässig nachzuweisen. In aller Regel ist aber nicht eindeutig festzustellen, worauf die jeweiligen genetischen Unterschiede zurückzuführen sind – ob sie Folge einer zufälligen, natürlichen Mutation sind, herkömmlich gezüchtet oder Ergebnis von Genome Editing. Sind wie in den meisten Fällen keine Fremdgene oder anderes eingeführtes Genmaterial mehr vorhanden, ist eine editierte Pflanze von einer natürlich entstandenen analytisch nicht unterscheidbar.
Eine Rückverfolgbarkeit von editierten Pflanzen über die gesamte Verarbeitungskette wäre nur durch ergänzende Informationen möglich, nicht aber durch eine analytische Nachweisbarkeit der betreffenden Pflanze. Das trifft auf alle Genome Editing-Verfahren zu.
Ist eine Pflanze, die mit Genome-Editing verändert wurde, gentechnisch verändert?
Bisher ist es international nicht einheitlich geklärt, ob editierte Pflanzen als gentechnisch veränderte Organismen GVO einzustufen sind. Die großen Agrarländer außerhalb der EU wollen differenziert und einzelfallbezogen vorgehen. Dabei wird berücksichtigt, welche Art der Veränderung an der DNA durchgeführt wird.
(1) Es wird eine gezielte Punktmutation ausgelöst. Bei der anschließender Reparatur der Bruchstelle sind zufällige Mutationen oder Sequenzverluste (Deletionen) möglich. Darüber hinaus werden aktiv keine weiteren Änderungen der DNA durchgeführt. (SDN 1)
(2) Es werden zusätzlich kurze DNA-Abschnitte an die Bruchstelle gebracht, die zu den Bruchkanten im DNA-Strang passen. Sie dienen als „Vorlage“ für das Reparatursystem. Auf diese Weise kann ein kurzes Stück DNA in die pflanzliche Erbinformation integriert werden, das nahezu identisch zur ursprünglichen Sequenz ist, aber sich nur in wenigen DNA-Bausteinen von dieser unterscheiden kann. Auf diese Weise können bestimmte Mutationen erzeugt werden. (SDN 2)
(3) Es werden längere DNA-Abschnitte – oder gar ein komplettes Gen – an die Bruchstelle herangeführt. Diese werden bei der Reparatur dauerhaft in das Erbgut eingebaut. (SDN 3)
Die Genome Editing-Variante (1) – manchmal auch (2) – wird außerhalb der EU meist als eine Mutation eingestuft, die nicht unter die jeweiligen Gentechnik-Gesetze fällt. Das entspricht den Empfehlungen vieler wissenschaftlicher Kommissionen und Vereinigungen. Dagegen führt Variante (3) in der Regel zu Pflanzen, die als GVO angesehen werden und entsprechend reguliert werden.
Die EU hat einen Sonderweg eingeschlagen. Im Juli 2018 entschied der Europäische Gerichtshof (EuGH), dass alle mit Genome Editing-Verfahren erzeugte Pflanzen unter die geltenden Gentechnik-Gesetze fallen. Ihre Verwendung, aber auch jede Freisetzung in die Umwelt müssen genehmigt werden, daraus hergestellte Lebens- und Futtermittel sind als „gentechnisch verändert“ zu kennzeichnen.
Alle Grafiken auf dieser Seite: pigurdesign / transgen.de




