RNA-Sprays gegen Schädlinge – der biologische Pflanzenschutz der Zukunft?
Mit der Corona-Pandemie trat sie ins große Rampenlicht: die RNA, die kleinere flüchtige Variante der Erbsubstanz DNA. Sie war der Schlüssel für die ersten und so verblüffend rasch entwickelten Impfstoffe. Könnte die RNA mit ihren erstaunlichen Fähigkeiten nicht auch Pflanzen vor Schädlingen und Krankheitserregern schützen? Inzwischen ist das mehr als eine verrückte Idee. Noch ist viel Forschung nötig. Doch schon bald könnten RNA-Sprays eine nachhaltige biologische Alternative zu chemischen Pflanzenschutzmitteln sein. Erste Produkte sind in den USA bereits zugelassen, auch ein neues Mittel gegen einen verheerenden Bienenschädling.
Um Schädlinge und Krankheitserreger in Schach zu halten, sind Landwirte auf Pflanzenschutzmittel angewiesen. Das führt zu besseren Ernten, hat aber auch negative Auswirkungen, etwa auf die Artenvielfalt. Diese sind „tiefgreifender“ als bisher angenommen, so die Ergebnisse einer internationalen Metastudie, für die über 1700 Untersuchungen ausgewertet wurden (Feb 2025). Auch deswegen soll der Einsatz „chemischer Pestizide“ in der EU halbiert werden.
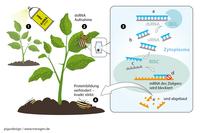
So funktioniert RNA-Spray: dsRNA (doppelsträngige RNA) wird auf die Blattoberfläche gesprüht (1). Ein am Blatt fressendes Insekt (z.B. ein Kartoffelkäfer) nimmt die dsRNA auf (2). In der Insektenzelle zerlegt das Enzym Dicer (DCL) die dsRNA in kleinere siRNAs (small interferring RNA) (3a+b). In dem Multi-Enzym-Komplex RISC (RNA-induced silencing) wird der Doppelstrang der siRNA aufgetrennt (3c). Ein Strang wird abgebaut, der andere bindet komplementär an die mRNA (messenger RNA) des Zielgens. Die darin codierte Information wird blockiert (3d) und die mRNA abgebaut (3e). Dadurch kann ein für den Käfer überlebenswichtiges Protein nicht gebildet werden. Das Insekt stirbt (4).
Zwar sind die ehrgeizigen Pläne der EU-Kommission erst einmal auf Eis gelegt, doch die große, drängende Herausforderung bleibt: Gleich, ob konventionell oder bio – eine Landwirtschaft, die nachhaltig und klimaangepasst ist, aber auch alle gut und ausreichend ernährt, kann nicht einfach so weitermachen wie bisher. Nötig sind Innovationen in vielen Bereichen, ganz besonders beim Pflanzenschutz. Die große Linie: Weg von der Chemie, hin zu mehr (Molekular-) Biologie.
Neben anderen Konzepten – etwa neuen genomischen Züchtungsverfahren (NGT) wie der Gen-Schere CRISPR/Cas oder der Optimierung von Mikroorganismen-Gemeinschaften (Mikrobiom) im Boden – versucht man seit einiger Zeit, Pflanzenschädlinge oder Krankheitserreger über einen natürlichen Mechanismus auszuschalten, der in den Zellen die Aktivitäten von Genen je nach Bedarf an- oder abschaltet. Er wird als RNA-Interferenz (RNAi) oder Gene Silencing bezeichnet (siehe Grafik im Kasten links).
Der Schlüssel dazu ist die RNA, die sich aus der Erbsubstanz DNA ableitet und in kleinen Molekülen millionenfach in den Zellen zirkuliert. Sie steuert dort verschiede Prozesse und reguliert die Aktivität einzelner Gene. Als Boten-RNA (mRNA) transportiert sie den DNA-Code vom Zellkern zu den „Eiweißfabriken“ (Ribosomen), wo das entsprechende Protein gebildet wird. Wenn es jedoch nicht benötigt wird, kann die betreffende mRNA-Sequenz durch Gene Silencing blockiert und damit „unlesbar“ gemacht werden.
Erstaunlicherweise funktioniert dieser Mechanismus nicht nur innerhalb der jeweiligen Pflanzenzelle, sondern auch in denen anderer Organismen. Wäre es nicht möglich, RNA-Interferenz für ein ganz neues Pflanzenschutz-Konzept zu nutzen? Maßgeschneiderte, funktionelle RNA-Sequenzen, könnten, in Pflanzenschädlinge oder Krankheitserreger eingebracht, dort Gene für lebenswichtige Schlüsselproteine blockieren und diese so unschädlich machen. Schon seit ein paar Jahren verfolgen Forschungseinrichtungen und Unternehmen diese faszinierende Idee.
Zunächst schien es naheliegend, wenn die gegen ihre Fraßfeinde gerichteten RNA-Sequenzen in der betroffenen Pflanze selbst gebildet werden. Einige solcher Pflanzen gibt es bereits. In den USA und China ist ein Mais zugelassen, der über eine neuartige, RNA-vermittelte Resistenz gegen den Maiswurzelbohrer, einen besonders hartnäckigen Schädling verfügt. Nun soll er auf die Felder kommen. Doch dieser Mais – genau wie ähnliche Pflanzen – produziert die „fremde“ RNA-Sequenz nur, wenn er zuvor entsprechend gentechnisch verändert wurde. Solche Pflanzen müssen nicht nur teure und zeitaufwändige Zulassungsverfahren durchlaufen, es mangelt zudem an Akzeptanz, besonders in Europa.
Doch es gibt eine Alternative: Die RNA-Sequenzen, die bei einem Schädling zu einer Blockade eines geeigneten Zielgens führen, können auch – ähnlich wie die RNA-Impfstoffe – biotechnologisch extern produziert und dann von außen auf die zu schützende Pflanze gesprüht werden – wie ein Pflanzenschutzmittel, das allerdings nicht mehr aus einem chemischen Wirkstoff besteht, sondern aus einer kurzen genetischen Information in Form einer maßgeschneiderten RNA-Sequenz. Anders als viele chemische Substanzen zerfällt RNA rasch. Auf dem Feld und in der Umwelt baut sie sich schon nach kurzer Zeit wieder ab. Die Pflanze selbst bleibt unverändert.

Prof. Dr. Aline Koch, Universität Regensburg, forscht seit vielen Jahren zu RNA-Sprays.
Wenn plötzlich Krankheitserreger oder Schädlinge auftreten, dann sind sequenzbasierte Wirkstoffe wie die RNA einfach schneller verfügbar. Damit können wir relativ schnell und günstig reagieren. Das benötigt keine zehn, zwanzig Jahre Entwicklungszeit wie bei herkömmlichen Pflanzenschutzmitteln.
Das ist nicht der einzige Vorteil des Spray-Konzepts. „Mit den RNA-Sprays können wir im Prinzip jede Pflanze, die man sich vorstellen kann, als Zielkultur schützen,“ so Aline Koch von der Universität Regensburg, die seit vielen Jahren zu RNAi und ihrem Potenzial für den Pflanzenschutz forscht. „Wenn die Technologie ausgereift ist, dann ist sie in der Breite anwendbar. Die technischen Limits wie bei der Gentechnik haben wir bei den Sprays nicht.“
Doch bis dahin muss sich die Forschung noch mit einer Reihe von Fragen beschäftigen.
Wie erreicht die blockierende RNA-Sequenz die Zielgene? Bei kauenden oder beißenden Insekten nimmt der Schädling die RNA direkt mit dem Pflanzenmaterial auf. Dafür muss sie eine Zeitlang auf der Blattoberfläche haften, doch wie stabil ist die RNA nach der Aufnahme durch den Schädling? Übersteht sie dort die Magen-Darm-Passage? Erreichen die zu einer Blockade fähigen RNA-Schnipsel überhaupt ihr Ziel? Bei saugenden Insekten wie etwa Blattläusen oder erst recht bei pathogenen Pilzen sind die Bedingungen für die Aufnahme und Stabilität der RNA noch einmal komplexer. „Wir müssen die verschiedenen Barrieren und Hürden kennen, die es zu nehmen gilt. Ich sprüh das mal und es funktioniert bei jeder Pflanze, so trivial ist es natürlich nicht“, sagt Aline Koch.
Was sind geeignete Zielgene, um Schädlinge oder Erreger wirksam und selektiv auszuschalten? Die effektivsten Ziele für eine RNAi-Blockade – in der Regel Gene für „lebensnotwendige“ Schlüsselproteine – sind oft solche, die auch in anderen Insekten vorkommen. Ein dagegen gerichtetes RNA-Spray würde nicht nur den jeweiligen Schädling treffen, sondern weitere Nicht-Zielorganismen, etwa nützliche Insekten. Um die erforderliche Spezifität und Selektivität herzustellen, müssen geeignete Zielgene gefunden werden, deren Blockade nicht nur schnell zum Absterben des jeweiligen Schädlings führt. Sie dürfen zudem nicht in anderen Organismen vorkommen oder dort von der RNA-Sequenz im Spray nicht erreichbar sein. „Ein Ansatz könnte sein, mehrere artspezifische Zielgene anzusteuern und sie in einem RNA-Spray zu kombinieren. Wir wollen so das Selektivitätslevel sukzessive erhöhen, statt auf die effektivsten Targets zu gehen, die im Labor funktionieren.“
Welche unerwünschte Nebenwirkungen könnte es geben? Wie sich in den Sprays enthaltenen RNA-Sequenzen in der Umwelt verhalten, wie stabil sie unter besonderen Bedingungen sind, und ob sie möglicherweise nicht nur die jeweiligen Zielorganismen schädigen, sondern auch andere, wird in verschiedenen Forschungsprojekten untersucht.
So hat sich eine schwedisch-britische Studie erstmals damit beschäftigt, ob sich aufgesprühte RNA – in diesem Fall gegen Fusarium-Pilze bei Weizen – auf die Mikroorganismen-Gemeinschaften auswirken, die auf der Oberfläche von Getreidepflanzen leben. Es zeigte sich, dass die Behandlung nur zu geringfügigen Veränderungen in der Diversität und Struktur der Bakteriengemeinschaften führte und die Pilzgemeinschaften relativ unverändert blieben. „Sprühinduzierten Gen-Silencing hat das Potenzial, den Pflanzenschutz mit minimalen ökologischen Auswirkungen zu revolutionieren“, so der Projektleiter Ramesh Vetukuri.

Gegen den Kartoffelkäfer. Das erste in den USA zugelassene RNA-basierte Pflanzenschutzmittel.

Bienenparasit Varroa-Milbe. Ein RNA-Spray soll das verheerende Bienensterben in den USA aufhalten.
Fotos: i-bio, Scott Bauer USDA-ARS/ Bugwood org
Gegen Kartoffelkäfer und Varroa-Milbe: Erste kommerzielle RNA-Sprays
Inzwischen sind die Kosten für die Produktion synthetischer RNA-Sequenzen der Sprays „dramatisch gefallen“, von mehreren Tausend auf weniger als einem Dollar je Gramm. Damit kann das RNA-Konzept im Pflanzenschutz auch auf großen Flächen konkurrenzfähig werden.
Ganz vorn bei anwendungsreifen RNA-basierten Produkten ist Greenlight Bioscience, ein junges US-amerikanisches Unternehmen aus Boston. Es hat eine Technologie-Plattform entwickelt, mit der spezifische RNA-Sequenzen hergestellt werden können, die jeweils auf bestimmte landwirtschaftsrelevante Schädlinge und Krankheitserreger zugeschnitten sind – ganz ähnlich wie bei den RNA-Impfstoffen, die rasch an immer neue Corona-Varianten angepasst werden konnten.
Der erste kommerziell erhältliche RNA-Spray von Greenlight (Produktname Calantha) richtet sich gegen den Kartoffelkäfer (Colorado Beetle), ein weltweit gefürchteter Fraß-Schädling. Inzwischen hat die US-amerikanische Umweltbehörde EPA Calantha zugelassen.
Nach Angaben von Greenlight ist der RNA-Spray in mehr als 100 Feldversuchen getestet worden. Als „nicht-chemische Pestizidalternative“ sei Calantha genau so wirksam wie herkömmliche Mittel. Nehmen Kartoffelkäfer die ausgebrachte RNA mit den Pflanzenblättern auf, stellen sie das Fressen ein und sterben. Nicht-Zielorganismen wie Marienkäfer, Honigbienen oder Schmetterlinge werden nicht geschädigt. Im Boden und in Wasser baut sich die dsRNA innerhalb von drei Tagen ab, übrig bleiben Nukleotide, natürliche DNA-Bausteine. Auch für andere Länder wird eine Zulassung für Calantha angestrebt.
Im September 2025 wurde ein weiteres RNA-basiertes Greenlight-Produkt von der EPA offiziell registriert: Norroa zielt gegen die Varroa-Milbe, in den USA die „größte Bedrohung der Honigbienenvölker“. Zwischen Juni 2024 und März 2025 gingen 1,7 Millionen Bienenvölker verloren, vor allem als Folge des Befalls durch Varroa-Milben, die zunehmend Resistenzen gegen die herkömmlichen chemischen Bekämpfungsmittel entwickelt haben.
In der Pipeline des Unternehmens befinden sich RNA-Sprays gegen weitere Schadinsekten, aber auch Pilzkrankheiten wie Rebenmehltau, Grauschimmel (Botrytis), und Fusarium, die viele Kulturarten, besonders Getreide, befallen und derzeit vor allem mit chemischen Mitteln bekämpft werden.
Noch ist allerdings nicht klar, wie und nach welchen Kriterien solche RNA-Sprays künftig zugelassen werden sollen. Wenn die Technologie einmal ausgereift ist, können die jeweiligen RNA-Sequenzen in den Sprays rasch und günstig an Schädlinge und Krankheitserreger – oder neu auftretende Varianten – angepasst werden. Doch dieser Vorteil, schnell auf neue oder resistent gewordene Schädlinge zu reagieren, würden langwierige, komplizierte Zulassungsverfahren zunichte machen. Eine Lösung könnte wie den den RNA-Impfstoffen sein, zwischen einer gründlichen Sicherheitsbewertung der Basistechnologie und kürzeren Verfahren für die spezifischen, wechselnden RNA-Sequenzen zu unterscheiden.
Entscheidend für die Zukunft der RNA-Sprays ist: Sie müssen selektiv wirksam sein – also ausschließlich den jeweiligen Schädling oder Krankheitserreger ausschalten, ohne andere Organismen zu schädigen. Wenn das gelingt, hätten RNA-Sprays tatsächlich das Zeug dazu, Pflanzenschutz und artenreiche Agrarlandschaften miteinander zu versöhnen.
Diskussion / Kommentare
 Kommentare werden geladen…
Kommentare werden geladen…
Themen
RNA-Sprays im Pflanzenschutz (Plant RNA Biotechnology, Universität Regensburg)
Im Web
- Wie RNA-Sprays den Pflanzenschutz revolutionieren, UR ScienceBlog
- Aline Koch, Georg Petschenka; Exogene Anwendung von RNA zur umweltfreundlichen Bekämpfung von Schadinsekten; Journal für Kulturpflanzen, 74 (03-04). S. 75–84, 2022
- Aline Pereira Rank, Aline Koch; Lab-to-Field Transition of RNA Spray Applications – How Far Are We? Front. Plant Sci., 15 October 2021 Sec. Plant Biotechnology
- Akademie der Naturwissenschaften Schweiz (SCNAT), RNA-Technologien: Wirkmechanismen, Anwendungen und Verabreichungsformen; 2024
- Swedish University of Agricultural Sciences, Gene-silencing spray to combat cereal disease is safe for the environment; 06 March 2025
- Sundararajan, P. et al. The impact of spray-induced gene silencing on cereal phyllosphere microbiota. Environmental Microbiome 20, 1 (2025)
- Joachim Budde, Mit RNA gegen Schädlinge, Spektrum, 11.06,2021
- Greenlight Bioscience; Our Pipeline: RNA Technology in Agriculture
- GreenLight Biosciences Launches Norroa, the First RNA-Based Treatment for Varroa Mites, Offering New Hope Amid Record Bee Losses; Greenlight Bioscience, 25 Sep 2025
- Auswirkungen von Pflanzenschutzmitteln auf Tiere, Pflanzen und Mikroorganismen viel tiefgreifender als angenommen; idw / Leibniz-Institut zur Analyse des Biodiversitätswandels; 13.Feb 2025
- Nian-Feng Wan et al, Pesticides have negative effects on non-target organisms: Nature Communications, 13. Feb 2025