Gene Drive - Gefahr oder wirksames Mittel gegen Malaria? UN-Konferenz berät über Moratorium
(28.11.2018) Die Hoffnungen sind groß: Mit Gene Drive könnten Moskitos, Überträger gefährlicher Infektionskrankheiten wie Malaria, endlich ausgerottet werden. Ob das neue Konzept tatsächlich funktioniert und ob es sicher angewandt werden kann, ist noch nicht ausgemacht. Viele Wissenschaftler wollen es weiterentwickeln und - wenn alles gut geht - in einigen Jahren im Freiland testen. Umwelt- und gentechnik-kritische Gruppen fordern dagegen ein weltweites Moratorium. Vor allem afrikanische Staaten sprechen sich dagegen aus.

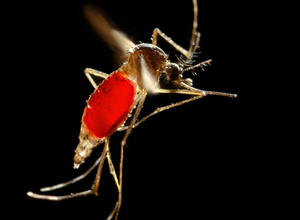
Verschiedene Moskito-Arten sind Überträger von Krankheitserregern, etwa Malaria, Dengue-Fieber oder Zika-Virus. Allein die Malaria fordert jährlich 400.000 Todesopfer.
Foto: Weibliche Anopheles-Mücke bei einer Blutmahlzeit (CDC, James Gathany); Großes Foto oben: Kopf einer Anopheles-Mücke (114-fache Vergrößerung (CDC, Paul Howell)
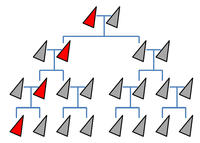
Normale Vererbung ohne Gene Drive: Eine bestimmtes Merkmal - etwa eine gentechnisch erzeugte Sterilität (rot) - wird nur an die Hälfte der Nachkommen weitergegeben. Wenn es keinen Überlebensvorteil vermittelt, wird sich das neue Merkmal (oder eine Mutation) in der Population nicht etablieren.
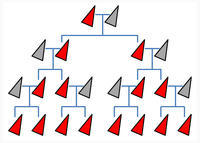
Mit Gene Drive wird dieses Merkmal bis zu 100 Prozent weitervererbt und breitet sich sehr schnell in der gesamten Population aus.
Auf der Vertragsstaatenkonferenz der UN-Konvention für Biologische Vielfalt (Convention on Biological Diversity, CBD), die noch bis zum 29. November in Sharm-el-Sheikh (Ägypten) stattfindet, ist es nur ein Nebenthema: Gene Drive. Doch es ist hochumstritten. Zahlreiche Organisationen des Global Food Movements, darunter die kanadische ETC-Group und die grüne Heinrich-Böll-Stiftung, verlangen ein Verbot aller Freisetzungen von mit Gene Drive veränderten Organismen und ein Ende der Forschungen.
In der Tat ist Gen Drive etwas grundsätzlich Neues, nicht einfach ein weiteres gentechnisches Verfahren. Ziel ist nicht die Veränderung einzelner Organismen, sondern ganzer Populationen – oder sogar deren Auslöschung. Moskitos, welche die Erreger gefährlicher Infektionskrankheiten übertragen, könnten damit wirksam dezimiert und aus menschlichen Lebensräumen verdrängt werden. An weiteren Anwendungen - bei Insekten, aber auch bei invasiven Tier- und Pflanzenarten - wird geforscht.
Die Grundidee von Gene Drive ist es, die Mendel‘schen Vererbungsregeln zu umgehen. Normalerweise werden bei der sexuellen Vermehrung je ein Chromosomensatz vom Vater und einer von der Mutter an die Nachkommen vererbt. Einzelne Gene liegen daher immer in zwei verschiedenen Ausprägungen (Allele) vor. Ereignet sich eine zufällige Mutation, schlägt sich diese in einzelnen veränderten DNA-Bausteinen auf nur einem Chromosom nieder. Das mutierte Gen wird daher nur an die Hälfte der Nachkommen weitergegeben. Wenn es ihnen keinen Überlebensvorteil vermittelt, wird sich die Mutation schon nach wenigen Generationen wieder verlieren (siehe Kasten).
Mit Hilfe der Gen-Schere CRISPR/Cas kann an einer bestimmten Stelle im Erbgut eine gezielte Punktmutation herbeigeführt werden - gleichzeitig auf beiden Chromosomen. Die Erbinformation für das veränderte Merkmal ist dann reinerbig vorhanden und wird an alle Nachkommen weitergegeben. Da zudem das CRISPR-Konstrukt an der Schnittstelle eingefügt wurde, löst es nach der Paarung mit einem noch nicht veränderten Organismus den gleichen Vorgang erneut aus.
Mit dieser Technik – inzwischen allgemein als Gene Drive bezeichnet - wird es grundsätzlich möglich, eine neue Variante eines Gens in einer Art Kettenreaktion innerhalb weniger Generationen in einer Population zu etablieren.
Malaria ist mit 200 Millionen Erkrankten im Jahr die gefährlichste Infektionskrankheit. Weltweit sterben jährlich 400.000 Menschen, 90 Prozent davon in Afrika. Zwar ist die Zahl der Opfer in den letzten Jahren deutlich gesunken (2004 1,8 Mio. Todesfälle), doch noch immer gibt es keinen wirksamen Impfschutz. Eine chemische Prophylaxe ist aufwändig und teuer. Oft hat der Malariaparasit gegen die heute verfügbaren Medikamente und Insektizide Resistenzen entwickelt. Malaria ist eine riesige gesundheitliche, soziale und wirtschaftliche Belastung, besonders in Afrika südlich der Sahara und in Südostasien.
Übertragen wird der Malaria-Erreger (Plasmodium) durch weibliche Stechmücken der Gattung Anopheles, indem sie das Blut von infizierten Personen – viele davon ohne deutliche Krankheitssymptome - aufnehmen. Um die Malaria zu besiegen, müssten die Anopheles-Mücken ausgerottet werden oder die Fähigkeit verlieren, den Erreger weiterzuverbreiten und so die Infektionskette zu unterbinden.
Das Ziel ist nicht neu. Doch ob mit Insektiziden, physikalischen oder biologischen Methoden - der Erfolg war bisher begrenzt. Jetzt könnte der Durchbruch gelingen – mit Gene Drive. Damit wird es möglich, ein “Sterblichkeits-Gen” in der Anopheles-Population zu verbreiten und so deren Vermehrung zu unterbinden. Oder die Mücken so zu verändern, dass der Malaria-Erreger etwa durch Antikörper unschädlich gemacht wird. Mit Gene Drive setzen sich die jeweils neu eingeführten oder veränderten Gene rasch durch: Nach relativ kurzer Zeit besitzen alle Organismen einer Population die über dieses Gen vermittelte Eigenschaft.
Die Hoffnungen sind groß - doch noch ist viel Forschung nötig, um tatsächlich an eine praktische Anwendung von Gene Drive zu denken. Finanziert mit viel Geld aus der Bill & Belinda Gates-Stiftung arbeitet Target Malaria, ein Verbund von Forschungseinrichtungen aus Europa und Afrika, daran, die Malaria mit Hilfe der Gene Drive-Technik zu bekämpfen. „Wir haben noch mindestens fünf bis sechs Jahre Forschung vor uns, bevor wir daran denken können, irgendwo Freilandversuche zu beantragen”, so Austin Burt vom Imperial College in London, Koordinator des Target Malaria-Projekts im Wissenschaftsmagazin Nature. “Wir wissen derzeit noch nicht, ob das Gene Drive-Konzept tatsächlich funktioniert.” Gerade werden Schutzsysteme entwickelt, die ein unbeabsichtigtes Entweichen der veränderten Moskitos aus den Laboren verhindern.
Viele gentechnik-kritische Gruppen wollen jedoch solche Forschungen erst gar nicht abwarten, sondern schon jetzt ein weltweites Moratorium. Auch Schädlinge spielten eine wichtige Rolle in Ökosystemen, ihre Auslöschung könne unvorhersehbare Folgen haben, so die von der kanadischen ETC-Group angeführten Kritiker. Zudem könnten die mit dem Gene Drive freigesetzten gentechnischen Veränderungen zu unerwarteten Nebeneffekten führen und seien nicht rückholbar.
Dagegen spricht sich ein offener Brief von mehr als hundert Wissenschaftlern gegen ein pauschales, unbegrenztes Moratorium aus. Ganz ähnlich wie zuvor die britische Royal Society appellieren sie an die UN-Konferenz, die laufenden Forschungsprojekte nicht durch restriktive Beschlüsse zu blockieren. Ein Moratorium “verhindert die vollständige Bewertung des potenziellen Nutzens von Gene Drive. Durchführbarkeit und die Modalitäten von Feldversuchen müssen von Fall zu Fall abgeschätzt werden.”
Ohnehin werden einem Moratorium wenig Chancen eingeräumt. Verbindliche Beschlüsse können die 200 Vertragsstaaten der UN-Konvention für Biologische Vielfalt (zu denen die USA nicht gehören) nur einstimmig fassen – und das ist kaum zu erwarten. Schon vor zwei Jahren scheiterte ein ähnlicher Vorstoß.
Vor allem afrikanische Staaten wehren sich gegen ein Moratorium, darunter Südafrika, Kenia, Ghana und Nigeria. “Malaria ist eine Belastung für uns. Es ist eine Krankheit, die wir nicht bewältigen können”, so Dr. Umar Traore, Leiter des Laboratoriums für Biologische Sicherheit in Burkina Faso. Daher begrüßen wir jede Möglichkeit, die Krankheit zu bekämpfen. Wir können es uns nicht leisten, dass es bei uns weiter Moskitos gibt, die Krankheiten übertragen. Wir müssen auf Gene Drive setzen.”
Im Beschlussentwurf für die UN-Biodiversity-Konferenz ist ein Moratorium nicht vorgesehen. (Nachtrag: Es wurde tatsächlich kein Moratorium beschlossen.)
Diskussion / Kommentare
 Kommentare werden geladen…
Kommentare werden geladen…
Themen
Gene Drives könnten eines Tages eingesetzt werden, um Malaria-Mücken oder Landwirtschaftsschädlinge zu bekämpfen. Wie funktioniert diese neue Technik? Wie groß ist ihr Potenzial und ihr Risiko? Und welche ethischen Fragen stellen sich? (Sciences Switzerland)
Wie wir einen unserer tödlichsten Feinde vernichten können - Gene Drive & Malaria (Kurz gesagt -In a nutshell)
Im Web
- Ban on ‘gene drives’ is back on the UN’s agenda — worrying scientists; Natur News 15.11.2018
- Scientists divided over new research method to combat Malaria; Guardian, 14.11.2018
- Africa kicks against proposed gene drive moratorium at UN Biodiversity Conference, Joseph Opoku Gakpo; 20.11.2018
- Convention on Biological Diversity; UN Biodiversity Conference, COP14, Egypt 2018
- Open Letter: Research on gene drive technology can benefit conservation and public Health; 14.11.2018
- Over 200 Global Food Movement Leaders and Organizations Reject „Gene Drives“; ETC Group; 16.10.2018