Neue genomische Techniken bei Pflanzen: Was die Gen-Schere kann - und was (noch) nicht
Von Juliette Irmer
Mit dem CRISPR/Cas-Verfahren lässt sich das Erbgut so gezielt und effizient verändern wie nie zuvor. Vor allem in der Pflanzenzucht sind mit der „Gen-Schere“ große Hoffnungen verbunden: Widerstandsfähige Sorten, die Krankheiten und Schädlingen standhalten, Dürreperioden überstehen und zugleich höhere Erträge liefern. Doch wie realistisch sind diese Erwartungen? Was kann Genom-Editing heute tatsächlich leisten – und welche Fortschritte sind in naher Zukunft zu erwarten?
Die Entdeckung des Genom-Editierwerkzeugs CRISPR/Cas 2012 markiert einen Wendepunkt in der Forschung und der Pflanzenzucht: Die Methode erobert dank ihrer praktischen Eigenschaften – präzise, benutzerfreundlich und günstig – weltweit die Labore. In der Pflanzenzucht ist die „Gen-Schere“ heute unentbehrlich, wobei der Begriff „Neue genomische Techniken“ (NGT) besser passt, weil inzwischen eine Vielzahl unterschiedlicher Editierwerkzeuge mit unterschiedlichen Fähigkeiten zur Verfügung stehen.
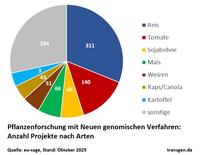
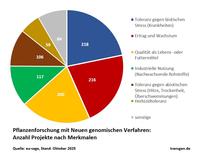
Publizierte Forschungsprojekte mit Neuen genomischen Züchtungsverfahren: Anzahl nach Arten und Merkmalen. Die überwiegende Mehrzahl der publizierten Projekte nutzten das CRISPR/Cas-System (92%), bis auf einzelne Ausnahmen alle aus der Kategorie SDN1.
Als Gradmesser des Fortschritts kann die Zahl wissenschaftlicher Studien dienen: Die EU-SAGE-Datenbank, ein Netzwerk aus 134 europäischen Forschungsinstituten, listet rund 1000 begutachtete Genom-Editing-Arbeiten aus 58 Ländern an 76 Pflanzenarten. Bei den untersuchten Nutzpflanzen liegt Reis vorn, gefolgt von Tomate, Weizen, Mais und Sojabohne. Die meisten Anwendungen zielen darauf ab, die Pflanzen widerstandsfähiger gegen abiotische Stressfaktoren wie Dürre, Versalzung oder Temperaturextreme sowie gegen Krankheiten und Schädlinge zu machen. Weitere Schwerpunkte sind die Steigerung von Ertrag und Qualität – etwa Geschmack, Nährwert und Haltbarkeit.
Der Wandel zeigt sich auch in der Regulierung: Länder wie die USA, Kanada, Indien oder China haben ihre Rechtsrahmen angepasst. Einfache genom-editierte Pflanzen (SDN 1, SDN2) unterliegen dort nicht mehr den strengen Auflagen der klassischen Gentechnik. Auch die EU-Kommission hat dazu ein reformiertes Gesetz vorgelegt, das derzeit mit den europäischen Institutionen – Mitgliedstatten und EU-Parlament – abgestimmt wird.
Ein Blick zurück
Um zu verstehen, warum im Zusammenhang mit der Gen-Schere oft von einer „Revolution“ gesprochen wird, lohnt ein Blick zurück in die Geschichte der Pflanzenzucht. Die grundlegenden Ziele haben sich über Jahrtausende kaum verändert: Es ging immer darum, Nutzpflanzen ertragreicher und widerstandsfähiger zu machen.
Die drei wichtigsten Kulturpflanzen des Menschen sind Mais, Weizen und Reis. Sie stammen von Wildgräsern mit winzigen Fruchtständen ab und wurden vor rund 10 000 Jahren durch künstliche Selektion domestiziert: Menschen vermehrten gezielt Pflanzen mit größeren Fruchtständen und erzielten so nach und nach bessere Ernten. Das war möglich, weil sich Pflanzen einer Art unterscheiden, sowohl im Aussehen als auch im Erbgut. Diese genetische Vielfalt macht Züchtung überhaupt erst möglich.
Einen gewaltigen Schub erhielt die Pflanzenzucht Mitte des 20. Jahrhunderts als entdeckt wurde, dass man Mutationen auch künstlich hervorrufen kann: Setzt man Pflanzensamen Strahlung oder Chemikalien aus, löst das massenweise DNA-Veränderungen aus, die zu neuen Eigenschaften führen können. Die meisten Mutationen sind neutral, wenige sind negativ und sehr wenige positiv. Da immer eine Mischung von Eigenschaften entsteht, bezeichnet man die Methode als ungerichtete Mutagenese. Um unerwünschte Pflanzenmerkmale zu entfernen, sind aufwendige Rückkreuzungen nötig. Auf diesem Weg entstanden über 3000 Sorten, darunter Hartweizen für Nudeln oder pinke Grapefruits.
Die klassische Gentechnik verfolgt erstmals einen gezielten Ansatz: Gene für bestimmte Eigenschaften, etwa Schädlingsresistenz, werden direkt ins Erbgut von Pflanzen eingefügt. Ein Beispiel ist Bt-Mais, der durch ein Bakterien-Gen Insekten abwehrt. Kritiker bemängeln das Überschreiten der Artgrenze und den Zufallseffekt: Niemand kann vorhersagen, wo das zusätzliche Gen im Erbgut integriert wird.
Präzision statt Zufall
Mit den Neuen genomischen Techniken (NGT) beginnt eine neue Ära der Pflanzenzucht: Das Erbgut kann nun gezielt und direkt verändert werden, ohne artfremde DNA einzusetzen. Zu NGT zählen Zinkfingernukleasen, TALEN und CRISPR/Cas-Systeme, die sich dank ihrer einfachen Handhabung durchgesetzt haben.
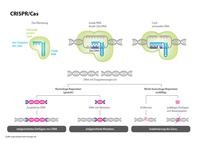
Erst ein präziser Schnitt an einer vorbestimmten Stelle im Genom, dann eine zufällige oder gezielte Reparatur der Bruchstelle. Wie die Gen-Schere funktioniert: Mehr dazu im Lexikon: Crispr/Cas
Durch Veränderungen des Cas9-Enzyms, der Leit-RNA (Guide RNA) sowie durch die Entdeckung neuer Cas-Proteine sind die Möglichkeiten des Genom-Editings in den vergangenen Jahren deutlich gewachsen: Varianten wie Base-, Prime- und Multiplex-Editing erweitern die Zahl der veränderbaren Stellen im Erbgut und ermöglichen noch präzisere Eingriffe.
Neben der Grundlagenforschung rücken zunehmend praxisnahe Anwendungen in den Vordergrund: Ein Schwerpunkt liegt auf Krankheitsresistenzen, daneben werden etwa der Vitamingehalt in Tomaten und Bananen erhöht oder Allergene in Weizen, Soja und Erdnüssen ausgeschaltet. Einige genom-editierte Sorten sind bereits zugelassen, viele weitere befinden sich in der Pipeline, noch wird aber keine Sorte großflächig angebaut.
- USA: Mehrere Pflanzen wurden zugelassen etwa Sojabohnen mit verbessertem Fettsäureprofil, Senfgrün, das weniger bitter schmeckt, Leindotter, Raps.
- Japan: Zugelassen sind zwei Tomaten-, eine Mais- und Kartoffelsorte sowie drei Fischarten. Verkauft werden bislang eine Tomatensorte und die drei schnell wachsenden Fischarten.
- China: Fünf geneditierte Sorten (Weizen, Mais, Soja und Reis) wurden Ende 2024 zugelassen, der Anbau soll in Kürze starten.
- Indien: 2025 wurden zwei geneditierte, klimaresiliente Reissorten zugelassen. Das Saatgut wird vermehrt, der Anbau soll in Kürze starten.
Was möglich ist
Veränderte Genaktivität. Ein Großteil aller durchgeführten Studien nutzt CRISPR, um Punktmutationen und kleinere Insertionen in bestimmte Gene einzufügen. Auf diese Weise lassen sich Gene schnell und unkompliziert ausschalten (knock-outs) und man kann beobachten, wie sich das auf die jeweilige Pflanze auswirkt. CRISPR ist damit zu einem zentralen Werkzeug der Grundlagenforschung geworden: Bei einer systematischen Mutagenese etwa wird eine Zielregion – meist ein Gen oder ein Teil davon – an jeder Position mutiert, um zu erkennen, welche Veränderungen funktionserhaltend oder schädlich sind. Auf diese Weise erhält man schnell ein Bild davon, welche Mutationen zu erwünschten Eigenschaften wie etwa einer Krankheitsresistenz führen können.
Neben dem Ausschalten von Genen rückt zunehmend auch die gezielte Veränderung der Genregulation in den Fokus. Schon kleine Veränderungen in Promotoren, also den regulierenden Regionen, können die Genaktivität feinjustieren und so neue Pflanzeneigenschaften erzeugen.
Züchtungsbeschleuniger. CRISPR/Cas-Systeme eröffnen neue Wege in der Pflanzenzüchtung. Durch den Vergleich von Wild- und Kulturpflanzen lassen sich die Genbereiche identifizieren, die im Laufe der Züchtung verändert wurden. Viele heutige Kulturpflanzen sind genetisch verarmt, da die Zucht vor allem auf hohen Ertrag ausgerichtet war. Mithilfe von CRISPR/Cas kann der Domestikationsprozess neu gestartet und beschleunigt werden. So könnten Pflanzen entstehen, die die Robustheit und den oft auch besseren Geschmack von Wildarten mit den Ertragsmerkmalen von Kulturpflanzen verbinden.
Ein bekanntes Beispiel ist die Wildtomate Solanum pimpinellifolium: Forschende schalteten mithilfe von Multiplex-Editing sechs Gene aus und erhielten nach nur einer Generation Pflanzen mit verbessertem Wuchs, mehr Blüten, größeren Früchten und höherem Lycopingehalt. Ähnliche Ansätze werden auch bei Walderdbeeren und wilden Reisarten verfolgt.
Neune genomische Techniken (NGT) gewinnen auch in der Hybridzüchtung an Bedeutung: Hybridpflanzen liefern oft höhere Erträge und sind widerstandsfähiger gegen Krankheiten und Umwelteinflüsse. Für die Produktion von Hybridsaatgut braucht es männlich sterile Linien, also Pflanzen ohne fruchtbaren Pollen. Während solche Eigenschaften früher mühsam in Spitzensorten eingekreuzt werden mussten, lassen sich heute mit NGT die für die Pollenbildung verantwortlichen Gene gezielt ausschalten. So entstehen stabile männlich sterile Linien, und die Hybridproduktion wird einfacher, schneller und lässt sich auf mehr Pflanzenarten anwenden als bisher.

Was mit CRISPR/Cas geht: Pflanzen können widerstandsfähiger gemacht werden gegen Pilz- und andere Krankheiten. Dadurch sind weniger Pflanzenschutzmittel nötig. Hier: Mehltau bei Weizen
Foto: Thomas Lumpkin / CIMMYT
Nachhaltiger und gezielter Pflanzenschutz. Genom-Editing eignet sich besonders gut, um Pflanzen gezielt gegen Viren, Bakterien oder Pilze resistent zu machen, da oft schon die Veränderung einzelner Gene ausreicht. Ein prominentes Beispiel – in China wurde die Sorte kürzlich zugelassen – ist mehltauresistenter Weizen, bei dem das MLO-Gen ausgeschaltet wurde. Das sorgt dafür, dass der Pilz die Zellen nicht infizieren kann. Weitere Beispiele zeigen das breite Potenzial der Methode: Das Ausschalten des DMR6-Gens führt dazu, dass Tomatenpflanzen ihre Abwehr stärker aktivieren. Die Tomaten zeigen dadurch eine breite Resistenz gegen mehrere Bakterien und Pilze. Viele Pflanzenviren brauchen bestimmte Wirtsgene zur Vermehrung. Werden diese Gene in Tomaten, Gurken und Kartoffeln ausgeschaltet, können die Viren sich nicht mehr gut vermehren und die Pflanzen bleiben gesund. Auch bei Bananen und Zitrusfrüchten gibt es vielversprechende Arbeiten zur Bekämpfung von Pilz- und Bakterienkrankheiten.
Im Unterschied zu chemischem Pflanzenschutz sind Genom-Editing-Ansätze zielgerichtet: Sie wirken nur gegen bestimmte Erreger und beeinträchtigen andere Organismen kaum. So könnte der Einsatz von Pflanzenschutzmitteln deutlich sinken.
Was (noch) nicht möglich ist
So vielversprechend Genom-Editing ist – die Methoden haben ihre Grenzen. Komplexe Eigenschaften wie Salz- oder Trockenresistenz lassen sich auch damit nicht einfach „herbeizaubern“. An solchen Merkmalen sind meist viele Gene beteiligt, häufig auch Transkriptionsfaktoren, die zentrale Stoffwechsel- und Signalwege steuern. Wird ein solches Gen an- oder ausgeschaltet, kann eine verbesserte Stresstoleranz leicht mit unerwünschten Nebenwirkungen in Wachstum oder Ertrag einhergehen.
Aktuelle Studien zeigen jedoch, dass sich bestimmte Stoffwechsel- und Regulationsnetzwerke gezielt beeinflussen lassen – etwa durch Multiplex-Editing oder Eingriffe in die Genregulation. Auf diese Weise konnten Forschende bei Reis, Tomaten und Weizen die Toleranz gegenüber Trockenstress bereits verbessern, ohne gravierende Nachteile festzustellen. Solche Ansätze könnten dazu beitragen, Pflanzen nach und nach an die zunehmenden Klima- und Umweltbelastungen anzupassen.
Problematisch ist auch die Entwicklung von Resistenzen gegen tierische Schädlinge wie Fraßinsekten. Pflanzen wehren sich in der Regel über komplexe Stoffwechselwege und produzieren Abwehrstoffe wie Tannine oder Glykoalkaloide. An diese Abwehrstrategien sind viele Gene und Signalwege beteiligt, die häufig mit Wachstums- und Qualitätsmerkmalen verknüpft sind. Wird die Abwehr dauerhaft aktiviert, kann das das Wachstum hemmen oder die Konzentration giftiger Substanzen erhöhen. Deshalb stößt Genom-Editing hier an seine Grenzen, und es wird weiterhin vor allem klassische Gentechnik eingesetzt.
Noch ineffizient ist derzeit das gezielte Einfügen größerer DNA-Abschnitte mithilfe von CRISPR/Cas. Die Methode erzeugt zwar einen präzisen Schnitt an einer definierten Stelle im Erbgut, das Einfügen neuer Sequenzen hängt jedoch von den natürlichen Reparaturmechanismen der Zelle ab. In Pflanzen ist der dafür benötigte Reparaturweg (Homologe Rekombination) allerdings unzuverlässig, sodass größere DNA-Stücke nur mit geringer Effizienz eingebaut werden.
Ein Blick in die Zukunft
Neue Genomische Techniken sind keine Wunderwerkzeuge, mit denen sich alle Herausforderungen der Pflanzenzüchtung auf einen Schlag lösen lassen. Dennoch haben sie das Potenzial, die Züchtung grundlegend zu verändern: Neue Sorten lassen sich schneller entwickeln, und es werden gezieltere DNA-Veränderungen vorgenommen als mit herkömmlichen Methoden.
Nach dem Erreichen des Editierziels schließen sich aber – wie bei konventionell gezüchteten Pflanzen auch – meist mehrere Jahre Züchtungsarbeit an, in denen die neue Pflanzensorte auf ihre veränderten Eigenschaften hin überprüft wird und in der sie sich in Freilandversuchen beweisen muss.
In Zukunft wird die Verknüpfung von Präzisionszüchtung und Künstlicher Intelligenz eine zentrale Rolle spielen. KI kann helfen, in den komplexen Genomen schneller jene Gene zu identifizieren, die für wichtige agronomische Merkmale verantwortlich sind. Darüber hinaus können molekulare Werkzeuge in Zukunft per KI entworfen werden, also Enzyme wie Nukleasen oder Rekombinasen, was noch flexiblere und breiter anwendbare Ansätze in der Pflanzenbearbeitung ermöglichen wird.
Titelgrafik erstellt mit Copilot
Diskussion / Kommentare
 Kommentare werden geladen…
Kommentare werden geladen…
Themen
Im Web, Quellen
- Boshu Li, Chao Sun, Jiayang Li & Caixia Gao, genome-modification tools and their advanced applications in crop breeding; Nature Reviews Genetics; 24 Apr 2024
- Yu Wang et al., Revolutionizing Agriculture With CRISPR Technology: Applications, Challenges, and Future Perspectives; Biotechnology Journal; 11 Sept 2025
- Alexios Polidoros et al., Genome-Editing Products Line up for the Market: Will Europe Harvest the Benefits from Science and Innovation? Genes, 01 Aug 2024
- Pu Yuan et al., Advancements in Plant Gene Editing Technology: From Construct Design to Enhanced Transformation Efficiency; Biotechnology Journal, 18 Dec 2024
- Thorben Sprink, Ralf Wilhelm, Frank Hartung, Genome editing around the globe: An update on policies and perceptions; Plant Physiology, Volume 190, Issue 3, November 2022
- Kevin V. Pixley et al, Genome-edited crops for improved food security of smallholder farmers; Nature Genetics vol 54, 7 Apr 2022